【研究活性化計画】空間分解能の高みへ。そこから見える新たな世界
電子顕微鏡の分解能は、材料科学の世界ではすでに0.05nmにまで到達した。一方、生命科学の世界では1nmの壁を超えるのが難しく、水をあけられた状態が続いてきた。そこに「何か」が潜んでいることを感じながら、多くの研究者が苦杯をなめてきた。基礎理論の提唱から60年以上経った今、その扉がついに開かれようとしている。問題克服まであと一歩と迫る自然科学研究機構生理学研究所特任教授の永山國昭氏が確立した位相差電子顕微鏡は、生命科学の新しい地平を切り拓く可能性を秘めている。

永山國昭(ながやま くにあき)氏(写真右)
香山容子(かやま ようこ)氏(写真左)
永山氏は、チューリッヒ工科大のR.Ernstの下でNMRによるタンパク質の立体構造解析を発展させるきっかけとなった二次元NMR法を確立した後、日本に帰国し、生理学研究所には1997年から所属し、位相差電子顕微鏡法の確立に取り組む。現在、生理学研究所特任教授。香山氏は、大学院卒業後、永山氏のもとでバイオイメージングに関する研究開発を行う。その後位相差顕微鏡の確立に従事する。
60年来の技術革新
1930年代にF. Zernikeによって位相差法が開発されたことで、透明の対象物にコントラストをつけて観察できるようになり、光学顕微鏡観察は大きく進んだ。理論的には電子顕微鏡にも同じ原理を導入できるはずで、事実、1947年にH. Boerschが位相差電子顕微鏡のアイデアを論文で発表している。だが、その後の歴史は頓挫の繰り返しだった。現在の高分解能電子顕微鏡観察は、位相板を使わずに電磁レンズで起こる球面収差という電子線の位相のズレを、焦点をずらすことで調節してコントラストを得る位相コントラスト法が主流となっている。O. Sherzerが1949年に提唱したこの方法によって、材料科学では原子レベルの分解能を得るまでになった。一方、生体試料は電子線損傷のため同じようには分解能が向上せず、また劇的に分解能を向上させる技術が登場しないまま時が流れた。そこにようやく登場したのが、2001年に永山氏らが発表したゼルニケ位相板を利用した位相差電子顕微鏡法だった(図1)。焦点ずらしをせずに得たウマ脾臓由来のフェリチンの位相差電子顕微鏡像は、焦点ずらしを行ったフェリチンの電子顕微鏡像にはない明瞭な粒子像を映し出されていた(図2)。生理学研究所で位相差電子顕微鏡の開発に取組み始めてから、3年目のことだった。
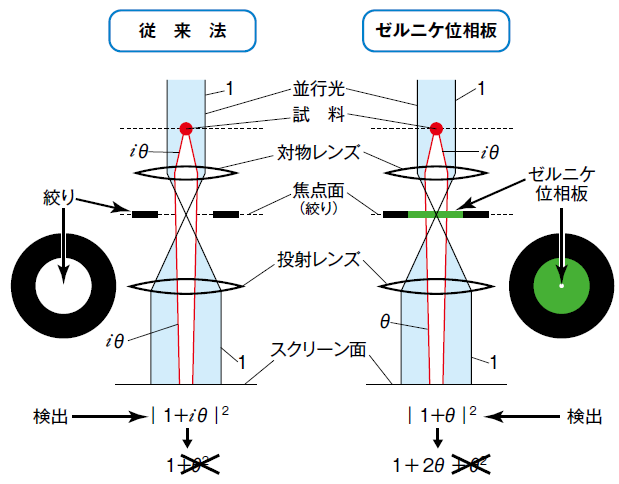
図1 従来法とゼルニケ位相違法の原理
ゼルニケ位相板は平行光(非散乱波;1)と拡散した散乱波(iθ)に対して異なる位相を付加する効果を持つ。非散乱波の位相は変化しないが、散乱波には-π/2の位相を付加するため、ゼルニケ位相板を通過した後の散乱波は虚数iθから実数θとなる。スクリーン面で2 乗検出をすると、従来法では位相の変化は見られないが、ゼルニケ位相差法では2θの位相コントラストが得られる。
(│θ│2 <<1によりθ2は0とみなす)

図2 位相差低温電子顕微鏡(300kV)と 低温電子顕微鏡(300kV)の観察像※1
(a) 位相差低温電子顕微鏡によるフェリチンの観察像。(b-d) 低温電子顕微鏡によるフェリチンの観察像。 それぞれb:2550nm、c:540nm、d:130nmでデフォーカスを行っている。
見えてきた問題の本質
「今思うと本当にビギナーズラックだったね。本質的な問題はまだ解けていないんですよ」。まさにこの言葉が位相差電子顕微鏡の難しさを表している。2001年に最初の成功例を発表したが、先人たちと同じように永山氏の前にも壁が立ちはだかることになる。原因は位相板の汚れ帯電。汚れがつくと位相板は帯電し電子散乱が起こり、分解能が著しく低下する。これこそが多くの挑戦者たちを退けてきた壁の本体であり、その解決のために60年の歳月がかかったといっても過言ではないと永山氏は振り返る。特に、生体試料の場合、帯電してしまう有機物と水で主に構成されているため、この問題が顕著に現れてしまうのだ。永山氏は問題解決に近付くことができた要因に、生理学研究所の研究環境を挙げる。位相板は一度汚れると使い物にならない。その度に取り替える必要がある。たった数枚の写真を撮るだけで、さらにひどいときは最初から位相板が汚れていることもある。その度にエンジニアを呼んで位相板を取り替えることは、費用的に考えて非現実的で、大きな研究障壁だ。このことが、多くの研究者をして問題の核心に迫ることを阻んできた。「位相板の作製技術と位相差電子顕微鏡に専門でかかわる技術員の両方がそろっていたおかげで、位相板を大量消費できる環境が整っていました。だからこそ、進んだんですよ。コストの問題を避けることができた。普通の研究室ではそうはいきません。この環境があるのは世界中でここだけ。ただそれは悲しいことでもあるんですよ。技術が広がらない。今でも失われた10年だったと思います」。
発想の転換
帯電汚れに問題があることはわかってきたものの、どのようにしてそれを克服するか、霧はまだ晴れていなかった。いかにクリーンな状態を作り出すか、試行錯誤を繰り返すものの一向に解決の糸口は見つからなかった。問題意識が研ぎすまされているときほど、ひょんなことがきっかけで新しいアイデアへとつながる。生体試料の帯電を回避するためにサンプルを炭素膜で覆い、導体内に静電気を閉じ込めて中和することについて詳細に記述された論文の査読をしているときのことだった。同じように位相板を炭素膜でシールドしてしまえば帯電を抑えることができるのではないか。理論的にこの手法は成り立つと確信した。研究室の持っている力全てを投入した開発の末、ついに帯電汚れに強いゼルニケ位相板が誕生した(図3)。有機物と水という高分解能の電子顕微鏡観察にとっての大敵を押さえ込むための計測系が一歩進んだ瞬間だった。
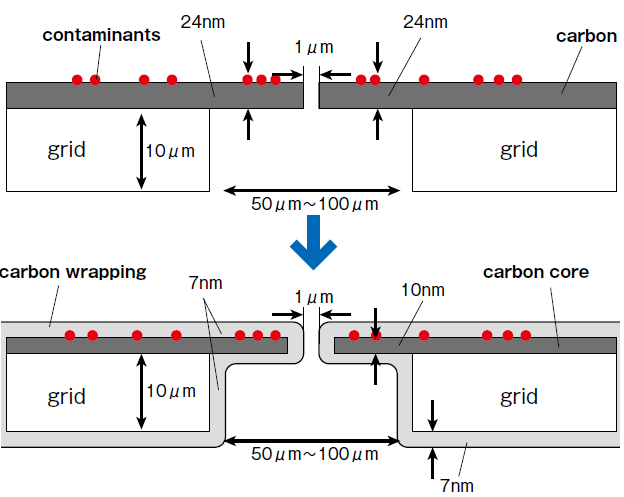
図3 炭素膜による帯電問題の回避
図中の赤い丸が汚れ、これが帯電の原因となる。ゼルニケ位相板の表面を炭素膜で覆うことで静電気を閉じ込めて中和ることができる。
新しい生命科学の価値観
光学顕微鏡の位相差法の微分干渉法に相当するヒルベルト微分法の観察方法も2001年に確立された。こうして明瞭なコントラストが得られるヒルベルト微分法、高い分解能が得られるゼルニケ位相差法という光学顕微鏡の世界で利用されている2つの位相差法と同じ観察環境が整った。そこに広がる世界は今までの電子顕微鏡の観察像をはるかにしのぐものだった。細胞膜や細胞質内部が明瞭に映し出されたシアノバクテリアのヒルベルト微分法の像はそれを物語っている(図4)。さらに、ゼルニケ位相差法で撮影したヘルペスウイルスの像ではウイルス内部に存在するDNAの状態までが浮き彫りにされている。また、この方法は誰でも最適な観察像を得られるという強みも持つ。デフォーカス(焦点のズレ)を調節して観察する従来法ではパラメーターの設定によって像の鮮明さをいかようにでも変えられたが、位相差電子顕微鏡法には明瞭な像を得るためのパラメーターの最適値が存在する。つまり、環境さえ整えば確実に最適な像が得られるのだ。さらに、原子分解能レベルのクリアな像が得られるようになれば、定量的な議論もできる。生物の画像がただの芸術品のレベルから、より詳細な議論のできるサイエンスに落ちてくるはずだと永山氏は指摘する。

図4 ヒルベルト微分法によるシアノバクテリアの電子顕微鏡観察像※2
3つの方法によるシアノクテリアの電子顕微鏡観察像。ヒルベルト微分法による低温電子顕微鏡像(a)は、デフォーカスによる低温電子顕微鏡観察像(b)、デフォーカスと染色を利用した電子顕微鏡像(c)よりも鮮明かつ内部構造を壊さない状態での観察像を我々に提供してくれる。
新しい技術を世界へ
2006年、位相差電子顕微鏡技術のさらなる開発と世界への普及を目的にテラベース株式会社が生理学研究所に設立された。永山氏を筆頭に、カーボン材料の電子顕微鏡観察に長い経験を持つ香山容子氏ら高い技術を持つメンバーで、ようやく探り当てた帯電問題の真の敵と対峙している。この最後の壁を超えられるかどうかが大きな意味を持つと永山氏は力説する。「本当にワクワクするというか、思っている結果がでるかどうかドキドキしています。これまでの全ての経験を注ぎ込んでるので、これがだめだったら何のための研究人生だったのかと考え込むよ。それにしても研究のピークが65歳を過ぎてからくるとは(笑)」。位相差電子顕微鏡法が世界化したとき、生命科学の世界の視界は今よりも遠くまで広がっているに違いない。位相差電子顕微鏡法の確立を阻んでいた真因発見とともに、これからの研究成果にますます期待が高まる。
※1 Danev R, Nagayama K. (2001) Transmission electron microscopy with Zernike phase plate. Ultramicroscopy. 88(4),243-52.
※2 Kaneko Y, Danev R, Nitta K, Nagayama K.(2005) In vivo subcellular ultrastructures recognized with Hilbert differential contrast transmission electron microscopy. J Electron Microsc (Tokyo) 54(1), 79-84.
