スピーディな相互作用解析により、タンパク質立体構造を区別する定量法を開発する

タンパク質は、その立体構造により機能を発揮する。当たり前のことだが、実際には多くのタンパク質は細胞内外で修飾を受けたり、切断されたりとその構造は動的に変化している。近年のバイオマーカー探索の中で、質量分析等により血液や体液中での存在が新たに発見されるものが多い中、その構造まで明らかになっているものは多くないのが現状だ。岐阜大学応用生物科学部の海老原章郎准教授は、分子間相互作用解析システムBLItzを用いた分別定量手法を開発し、構造活性相関に迫ろうとしている。
UserInterview
古くて新しいターゲット

海老原 章郎 氏
岐阜大学 応用生物科学部 応用生命科学課程 准教授
海老原氏がターゲットとしているのは、レニン・アンジオテンシン系で働くプロレニンおよび(プロ)レニン受容体(PRR)だ。この反応系の中では、酵素レニンが基質アンジオテンシノーゲンを切断することが血圧調節に繋がることが古くから知られていた。さらに2002年には、レニンの前駆体であるプロレニンがPRRに結合することで構造変換を受け、レニンと同様の活性を示すことが明らかにされた。同時にプロレニンとPRRとの結合は細胞内シグナル伝達を起こし、糖尿病性腎症などの臓器障害に繋がる。海老原氏が所属する研究グループはこの受容体の性質を酵素科学的に解析するため、クローニングとタンパク質の調製を進めてきた。
バイオマーカーの立体構造に多様性はあるのか
PRRの調製には苦労している、と海老原氏は話す。当初は約300アミノ酸の細胞外ドメインを無細胞系で生産して活性を持つ受容体を作っていたが、大量調製のために大腸菌の発現系に移すと不溶化しやすくなってしまった。調べてみると、どうやら複数の立体構造が混在しているらしい。「そんな中で2009年、様々な患者の血中や尿中に細胞外ドメインが遊離していることがわかったのです」。この可溶型PRRは臨床現場でELISAによる定量が行われるようになった。だが、体液中でも立体構造の多様性があるのではと疑った海老原氏は、異なるエピトープに結合する十数種類の抗PRR抗体とBLItzを用いて分別定量法の開発を始めたのだ。
短時間の検討で解析条件を決められるBLItz
各抗体による結合・解離速度を測定すれば、どのエピトープが露出した構造が多いのかを調べられるはず。そう考えて現在はBLItzを使った測定条件の検討を進めている。まずは結合の有無を調べているが、なんと20条件の検討が3時間程度で済むという。センサーチップを抗体溶液とサンプル溶液に浸すだけでデータを得られる(図1)ことから、「この条件はダメだなとわかったら、すぐやめられるのが便利ですね」と話す。
病態と構造との相関があるとおもしろい、と海老原氏は言う。もしそうなったら、他のマーカータンパク質についても、ELISA定量系を見直す必要があるかもしれない。BLItzによるスピーディな測定と豊富な抗体ラインナップの組み合わせから、立体構造までを見分ける新しい定量法が生まれようとしている。

図1 BLItzの使用法
(a) 使用の際は、Protein Aや抗体等が固定化されたバイオセンサーチップをアームに取り付ける。(b)サンプル溶液4μLをサンプルホルダーにセットし、アームを下ろせば測定が始まる。
小型、簡便、強力な相互作用アッセイ
BLItzは手のひらに乗るほどの小型サイズながら、簡便にラベルフリー、リアルタイムの分子間相互作用測定が可能だ。使用の際は、測定部のアームを上げて専用のバイオセンサーを設置し、4μLのサンプル溶液をセンサーに浸せば測定が開始される。自作の抗体と抗原とのアフィニティを見たい場合は、まず抗体溶液をウェルに入れ、ProteinAまたはGを固定化したセンサーを浸す。結合がプラトーに達したら、再びアームを上げてウェルを洗浄し、抗原溶液を加えてアームを下げるだけで良い。それらにかかる時間はわずか数分。細胞抽出液や血清などクルードサンプルを使用できることも大きな特徴といえる。
肝はバイオセンサーにあり
測定の仕組みは、Biolayer Interferometry(BLI)という技術だ。バイオセンサーは、先端の表面近くに屈折率の異なる素材がサンドイッチ状に重なり、先端の層には抗体やNi-NTA、ProteinGなどが固定化されている。センサー内部から白色光を通すと、その一部は屈折率が変わる界面で反射し、また反射光同士は互いに干渉する。センサー表面の抗体等に他の分子が結合すると、タンパク質が作る層の厚みがごくわずかに変化し、反射光のスペクトルが変化する(図2)。BLItzはこのスペクトルを解析し、簡便な相互作用解析を可能にしているのだ(図3)。計測に用いる光が通過するのはバイオセンサー内部および表面のタンパク質層のみであるため、サンプル溶液中の夾雑物量など外部環境による影響を受けにくい。
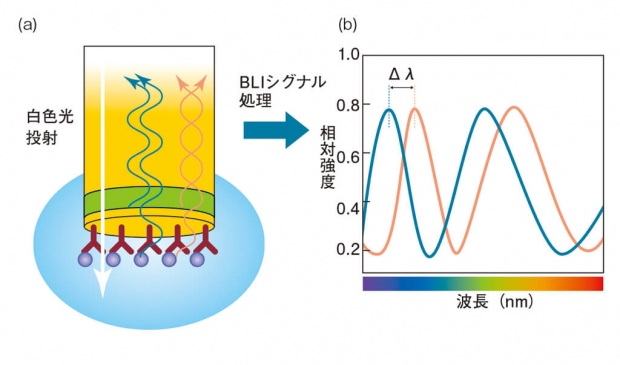
図2 BLIの原理
(a) センサーチップの内部から白色光を投射すると、屈折率が変化する界面で一部の光が反射する。それぞれの界面で反射した光同士が干渉を起こす。センサー表面に固定化した分子に他の分子が結合すると、反射の界面位置が変化する。それによって、反射光の干渉の仕方も変わる。(b)反射光のスペクトル上で、ピークのシフト(Δλ)が起こる。これを解析することで、センサー表面に形成された高分子の膜厚がわかる。
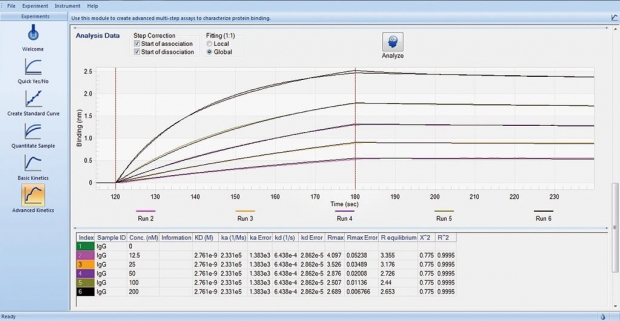
図3 専用ソフトウェアにより簡便な測定が可能
ウインドウ左側のボタンにより、結合対象タンパク質の存在の有無、検量線作成、タンパク質定量、反応速度解析など解析の種類を選んで使用する。
ELISAやWestern blottingに替わるアプリケーション
日本ポールではバイオセンサーラインナップとして、ストレプトアビジン、Protein A/G/L、Ni-NTA、そしてヒトIgG Fc、マウスIgG Fc、GSTに対する抗体などが固相化されたものを取り揃えている。これにより、これまでELISAやWestern blottingにより行ってきたターゲットタンパク質の存在確認を、BLItzで行うことも可能だ。アッセイ時間も圧倒的に短縮できる。さらに反応速度を指標として、in vitro 反応系の条件最適化に利用することもできるだろう。
さらに今年、低分子との相互作用にも対応し、温度調整もできる高感度測定システムOctet K2 Systemがラインナップに加わった(図4)。96ウェルプレートに反応に必要な溶液をあらかじめセットするオートメーション型で、結合から解離までフルカイネティクス解析もできる。2つのチャネルで2条件を同時に測定できるため、測定の時間と手間を大幅に低減できるはずだ。豊富な情報量を簡便、短時間に分析できる技術により、今後も新しい知見が生まれていくだろう。
提供:日本ポール株式会社
- [ 所在地 ] 〒163–1325 東京都新宿区西新宿 6–5–1
- [ T E L ] 03–6386–0995
- [ E-mail ] [email protected]
- [ U R L ] http://www.blitzmenow.com/
日本ポールは第30回リバネス研究費で「Pall ForteBIO賞」の公募を行います。 ▷詳細はこちらを参照