再生医療実現に向けた 新しい培養技術
ヒトES細胞の樹立、そしてiPS細胞の開発以降、再生医療はそれまでと比較にならないほどの現実味を持ちはじめた。新たな研究成果が一般の新聞やニュースで紹介され、それらの話題はアカデミアの外へと拡散し続けている。一方で、基礎的・学術的研究成果が臨床医療へと辿り着くまでには、細胞生物学的な研究のみでなく、組織工学技術の発展が欠かせないだろう。今回はそのような再生医療の実現化を支える技術の中で、特に三次元細胞培養技術にフォーカスを当てる。
より自然な形状で、より自然な状態を再現する
「10年後には、二次元の細胞培養を用いた研究は予算を獲得するのが難しくなるだろう」。2003年にそのような予言がVanda PharmaceuticalsのMihael Polymeropoulosによってなされた1)。それから9年、まだ予言のような状況には至っていないが、それでも三次元細胞培養に関連する論文数は 増加の一途をたどり、各社から様々な三次元培養試薬・装置が発売されてきている。このトレンドを後押しするのは、単純な動機だ。細胞を平面でなく、立体的に配置した方が、より自然な状態を再現できるのだ。
生体内の組織中では、細胞はお互いに結合するだけでなく、細胞外マトリクスが作る構造により支持されている。そこにはコラーゲンやエラスチン、ラミニンなどのタンパク質が存在し、細胞間のコミュニケーションを手助けしている。細胞表面にある受容体、特にインテグリンファミリーが細胞外マトリクスに結合し、 周辺環境に対してどのように応答するかを決定する。この複雑な環境を考えると、平面上に単層として広がる培養形態では、細胞本来の性質が再現できなかったとしても不思議ではないだろう。
事実、立体的な培養環境にある細胞が、平面の時とは全く異なる振る舞いを示したという報告は数多くある。例えばGrace N. Liらの研究によると、神経芽腫の培養系において、三次元培養ではより神経突起を多く伸ばし、マイクロアレイの結果1766個の遺伝子の発現が異なってい た2)。またYan Liらによれば、親水化加工したポリエチレンテレフタレート(PET)の不織布を用いた立体培養系で臍帯血細胞からの造血能を測定したところ、サイトカイ ンの添加無しに、2次元培養と比較して30~100%も多くの細胞を産生した3)。その他、ヒストンH3の脱アセチル化によるヘテロクロマチン構造の増加 により、放射線抵抗性が増すという報告4)やES細胞の分化能への影響など、様々な側面での違いが見出されている。
三次元培養を実現する技術
以上のように新たな知見を生み出している三次元培養を実現するには、現在大きく分けて以下のような方法がある。
(1)多孔性担体内での培養
細胞外マトリクス分子を含むゲルなど、内部に細胞が入り込める孔を持つ担体内を用いることで、生体内組織を人工的に模倣した環境で細胞培養を行うことができる(図1)。様々な会社から担体が市販されており、素材にはコラーゲンやハイドロゲル、あるいは表面処理を行ったPETの不織布などが用いられている。温度応答性ハイドロゲルを用いることで、37℃下においてゲル内で細胞が増殖した後に冷却し、ゾル状にして細胞塊を単離するといったことも可能だ。広島大学の越智光夫教授が主導する臨床研究により、アテロコラーゲンゲルを基材として培養された軟骨組織が、患者の欠損した軟骨に定着することも確認され ている。
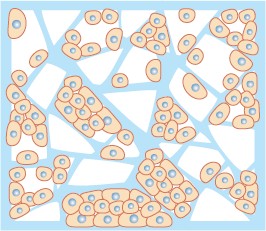
図1 多孔性担体での培養
ゲルや不織布内部に張り巡らされた足場を利用し、細胞が立体的に増殖していく。
(2)プレート上でのスフェロイド形成
スフェロイドとは多数の細胞の凝集体で、その直径は数百μmにもなる。培養ディッシュ底面を細胞非接着表面とし、その中に直径100μm程度の細胞接着表面を作ることで、狭い領域内に細胞を凝集させ、スフェロイド形成を促すことができる5) 株式会社トランスパレント)(図2a )。ディッシュ底面にナノファイバーを敷き詰めたり(NanofiberSolutions)ナノサイズの格子を作ったり(Scivax株式会社)することで、細胞の接着を抑える方法もある(図2b, c)。株式会社セルシードのHydroCellは、ディッシュ底面を超親水性ポリマーでコートすることにより、細胞接着を阻害してスフェロイド形成を促進している。他に、フルクトース・ガラクトースで修飾したデンドリマーを基板上に固定すると、その周辺に細胞が結合してスフェロイドを形成するといった報告もされている6)。
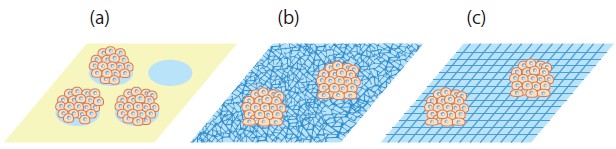
図2 プレート上でのスフェロイド形成
(a)細胞がディッシュ底面の非接着性表面(緑色)を避け、直径100μmの接着性表面(水色)のみに集積する。(b)(c)ナノファイバーあるいはナノサイズの格子を敷き詰めることで、細胞の接着を抑制して広がりを抑え、スフェロイドを形成させる。
(3)液滴中でのスフェロイド形成
チップ先端が通る程度の小さな穴があいたプラスチックディッシュを用い、穴の部分に培地の液滴をぶら下げるように保持し、その内部でスフェロイドを形成させる方法(3DBiomatrix, Insphero)(図3)。ひとつの液滴にひとつのスフェロイドが作られ、穴を通して細胞の追加等もできる。そのため、複数種の細胞を混在させたり、1種類の細胞が塊を形成した周りを別の細胞で覆ったりするなど、他の方法では難しい共培養系の構築ができる。また、非接着性のハイドロゲルに微細なウェルを作り、そこに培地と細胞を入れるという方法もある7)。
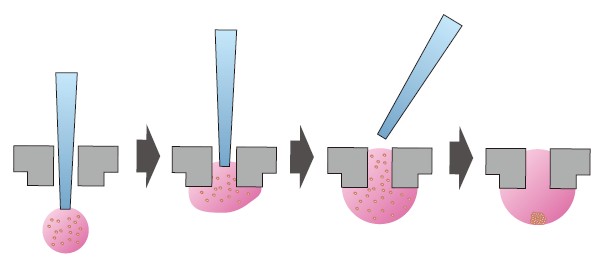
図3 液滴中でのスフェロイド形成
ディッシュにあいた穴にチップを通し、チップ先端に細胞入り培地ドロップを作る。そのままチップを引き抜くとドロップがディッシュの穴に留まり、細胞は重力に従ってドロップの底で凝集する。
(4)細胞積層
平面で培養した細胞シートを積み重ねる、または細胞層の上に新たな細胞層を培養していく方法。前者は東京女子医科大学の岡野光夫教授が開発した細胞シート工学技術の応用として開発が進められている。細胞シート工学技術では、ゲル状態の温度応答性ハイドロゲル上に細胞を播種し、単層の細胞シートを作る。その後、温度を下げてハイドロゲルをゾル化し、シートを単離する。これを積層していくことで、立体的な組織を構成する方法である8)(図4a)。後者は、大阪大学の松崎典弥氏が開発した方法で、単層培養した細胞にフィブロネクチンとゼラチンを投与すると細胞表面を覆うように接着し、その上で次の層の細胞が定着、増殖できるようになるというものだ9)(図4b)。
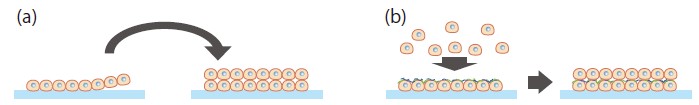
図4 細胞積層
(a)平面培養してシートを形成した細胞を、そのまま他の細胞シートに積層することで立体化していく。
(b)平面培養した細胞にフィブロネクチン、ゼラチンを投与すると、細胞上に薄いフィルムを形成する(緑および青線)。その後、細胞を追加すると、多層化していく。
(5)磁場を用いた浮遊培養
2010年にテキサス大学のSouzaらによって発表された新しい方法で、ポリリジンベースの磁性ナノ粒子とともに細胞を培養し、ディッシュ上部に磁石を置くことで、磁力によって細胞が浮遊した状態でスフェロイドを形成するというものだ10)(n3D Biosciences)(図5)。特殊なディッシュや機器の必要がなく、細胞を簡単に扱えることが利点だという。
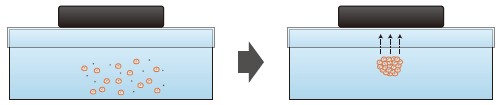
図5 磁場を用いた浮遊培養
ディッシュの蓋に磁石を起き、ポリリジンベースの磁性ナノ粒子とともに細胞を培養する。
磁性ナノ粒子を取り込んだ細胞は、磁力によって培地中に浮遊した状態でスフェロイドを形成する。
穴あきの磁石を使うことで、スフェロイドを浮遊させたまま顕微鏡観察することも可能。
再生医療を見据え、産学連携の成果が広がる
三次元細胞培養は再生医療実現のために重要な技術と考えられる。前述した東京女子医科大学の岡野氏の研究は、内閣府の最先端研究開発支援プログラム(FIRST)に採択されている「再生医療産業化に向けたシステムインテグレーション-臓器ファクトリーの創生-」において、細胞シートの大量培養および多層化をこれまでの手作業からファクトリー化することで、再生臓器創生のための基盤技術を確立することを目的としている。また大阪大学の松崎氏は、新エネルギー・産業技術総合開発機構(NEDO)の助成事業として「テーラーメード型三次元複合組織の生体外構築を可能とする細胞積層化技術の開発」を推進し、その成果が住友ベークライトより細胞積層組織培養キット「CellFeuille (セルフィーユ)」として販売されている。現在のところ、三次元組織・器官の構築そのものを直接の達成目標として掲げた施策があるわけではないが、株式会社トランスパレント、株式会社セルシード、Scivax株式会社(日本)、Nanofiber Solutions、3D Biomatrix、n3DBiosciences (アメリカ)、InSphero(スイス)などそれぞれの技術を製品化したベンチャー企業が生まれている。また、岡野氏の研究成果も、いずれ細胞シート工学技術を軸とするセルシード社より上市することが予想される。産業界が活気づくこの分野は、これから加速していくはずだ。
1) Abbott A. (2003). Cell culture: Biology’s new dimension. Nature. 424 (6951): 870-872.
2) Li GN., et al. (2007). Genomic and Morphological Changes of Neuroblastoma Cells in Response to Three-Dimensional Matrices. Tissue Engineering. 13 (5):1035-1047.
3) Li Y., et al. (2001). Human Cord Cell Hematopoiesis in Three-Dimensional Nonwoven Fibrous Matrices: In Vitro Simulation of the Marrow Microenvironment.
J. Hematotherapy & Stem Cell Research. 10 (3): 355-368.
4) Storch K., et al. (2010). Three-Dimensional Cell Growth Confers Radioresistance by Chromatin Density Modification. Cancer Research. 70: 3925-3934.
5) Ohtsuka H., et al. (2005). Two-Dimensional Array Formation of Multi-Cellular Spheroids on Micro-Patterned Polymer Brush Surface. Key Engineering Materials. 288-289: 449-452.
6) Kawase M., et al. (2000). Immobilization of ligand-modified polyamidoamine dendrimer for cultivation of hepatoma cells. Artif. Organs. 24 (1): 18-22.
7) Napolitano AP., et al. (2007) Scaffold-free three-dimensional cell cultureutilizing micromolded nonadhesive hydrogels. BioTechniques. 43: 494-500.
8) Haraguchi Y. (2012). Fabrication of functional three-dimensional tissues by stacking cell sheets in vitro. Nature Protocols. 7: 850-858.
9) Matsusaki M. (2007). Fabrication of Cellular Multilayers with Nanometer-Sized Extracellular Matrix Films. Angew. Chem. Int. Ed. 46: 4689-4692.
10) Souza GR. (2010). Three-dimensional tissue culture based on magnetic cell levitation. Nature Nanotechnology. 5: 291-296.
