【研究活性化計画】片手サイズの分子間相互作用解析装置
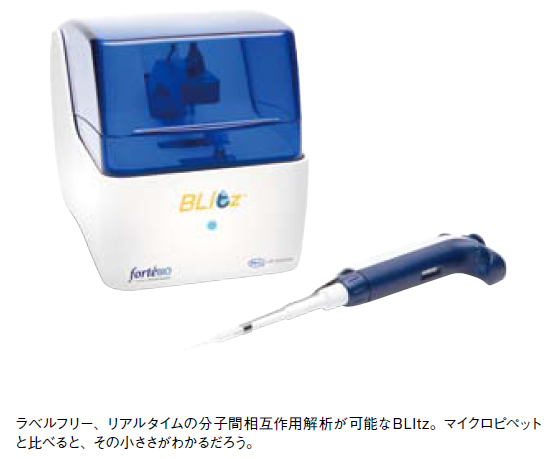
日本ポール株式会社のBLItzは、分子間相互作用と反応速度の解析を、片手で持てるほどの装置サイズで実現した。1990年代以降、シークエンサーの普及が遺伝学研究を推し進めたように、分析技術の発展と普及は、研究分野全体の進歩を促す。簡便な分子間相互作用の解析を可能にしたその先には、どのような研究の発展があるだろうか。
小型、簡便、強力な相互作用アッセイ
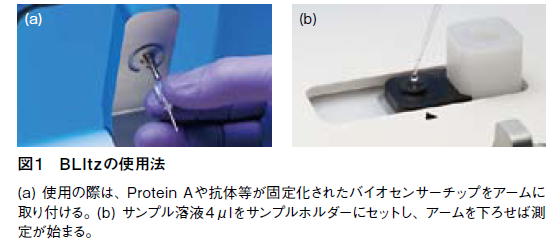
BLItzのサイズは横15.3cm× 奥行き22.2cm× 高さ17.4cm。小型ながら、簡便にラベルフリー、リアルタイムの分子間相互作用測定が可能だ。使用の際は、測定部のアームを上げて専用のバイオセンサーを設置し、サンプルウェルに4μlのサンプル溶液を滴下する(図1)。そしてアームを下げるだけで、センサーがサンプル溶液に浸り、測定が開始される。たとえば自作の抗体と抗原とのアフィニティを見たい場合は、まず抗体溶液をウェルに入れ、ProteinAまたはGを固定化したセンサーを浸す。そして結合がプラトーに達したら、再びアームを上げてウェルを洗浄し、抗原溶液を加えてアームを下げるだけで良い。それらにかかる時間は、わずか数分だ。
マイクロ流路を使用しないこの方法により、細胞抽出液や血清など、クルードサンプルの使用が可能だ。サンプルの粘性が高い場合、マイクロ流路だと詰まってしまったりするが、バイオセンサーを浸すだけで良いので、BLItzではそれが問題になることがないのだ。
論文におけるBLItz使用例
上記の特徴を活かし、BLItzはすでに様々なアプリケーションを生んでいる。すでに論文となっている使用例を紹介しよう。
南カリフォルニア大学のTeshome L. Aboyeらは、HIVの血球細胞への侵入を防ぐ、新規のシクロチド(環状ペプチド)について2012年にJounal of Medicinal Chemistryで報告した※1。彼らはこの論文の中で、シクロチドの血中安定性を示すため、血清の希釈液を用いて、血清中の全タンパク質との結合、解離速度を測定した。投与したペプチドは、血清タンパク質と相互作用をすることで安定性が増すことが知られている※2。一方で活性を示すためには、適度に乖離する必要もあるため、このようなデータを示したのだ。
またメイヨー・クリニックのTheodore A. Craigらは、アポトーシス関連タンパク質DREAMの作用機序を調べる中で、Ca2+存在下でhexokinase Iと相互作用をすることを示した※3。その中で彼らは、まずストレプトアビジン固定化バイオセンサーにビオチン化DREAMを結合させ、次にhexokinase Iとの結合、そしてバッファーのみでの洗浄を行い、解離速度(KD)、結合速度定数(ka)、解離定数(kd)を測定している。
肝はバイオセンサーにあり
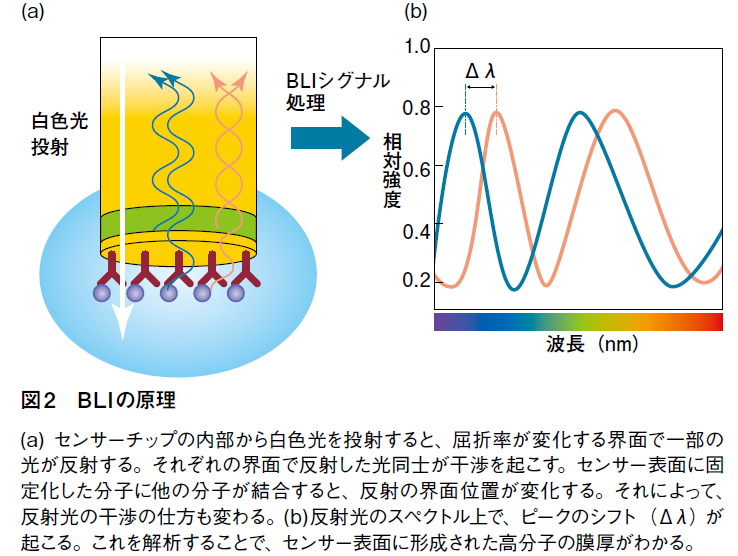
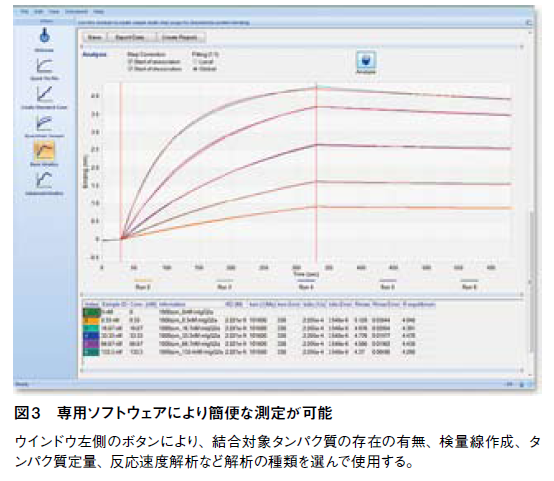
測定の仕組みは、Biolayer Interferometry (BLI)という、生体高分子の薄層で起こる光の干渉を指標として解析を行う技術である。測定部のアームに設置するディスポーザルのバイオセンサーは、先端の表面近くに屈折率の異なるSiO2、Ta2O5がサンドイッチ状に重なっており、一番先端のSiO2層には、抗体やNi-NTA、ProteinGなどが固定化されている。このセンサー内部から白色光を入射させると、その一部はSiO2からTa2O5への界面、表面分子から液相への界面など、屈折率が変わる部分で反射し、また反射光同士は互いに干渉する。センサー表面の抗体等に他の分子が結合すると、タンパク質が作る層の厚みがごくわずかに変化するため、反射光のスペクトルが変化する(図2)。BLItzは独自のソフトウェアでこのスペクトル解析を行い、簡便な相互作用解析を可能にしているのだ(図3)。この方法は、計測に用いる光が通過するのはバイオセンサー内部および表面のタンパク質層のみであるため、サンプル溶液中の夾雑物量など外部環境による影響を受けにくい。そのため、クルードサンプルの使用が可能となっている。
簡便な分析がもたらす多様なアプリケーション
日本ポールでは、BLItz専用のバイオセンサーラインナップとして、ストレプトアビジン、Protein A/G/L、Ni-NTA、そしてヒトIgG Fc、マウスIgG Fc、FLAG、GSTに対する抗体などが固相化されたものを取り揃えている。これによって可能となるアプリケーションは、先に示したような論文における事例の他にも多種考えられる。たとえば、タンパク質の高発現クローンを探したり、タンパク質精製後にターゲットタンパク質が存在するかどうかを確かめたりするため、これまでELISAやWestern blottingを行なっていた時間を圧倒的に短縮できる。また、あるタンパク質と相互作用を他のタンパク質との相互作用が、ビオチン化等の修飾によって変化してしまうかどうかを確認することが可能だ。さらに反応速度を指標として、in vitro反応系の条件最適化に利用することもできるだろう。
簡便かつ豊富な情報量を持つ分析により、これまで複雑な実験系を経なければ得られなかったデータを、数分のうちに手にすることができるようになる。その違いがもたらす恩恵は、大きなものになるはずだ。
※1 Aboye T. L., et al. J. Med. Chem. (2012), 55, 10729-10734
※2 McGregor D. P. Curr. Opin. Pharmacol. (2008), 8, 616-619
※3 Craig T. A., et al. Biochem. Biophys. Res. Commun. (2013), 433, 508-512
●日本ポール株式会社
[ 所在地 ] 〒163-1325 東京都新宿区西新宿 6―5―1
[ T E L ] 03-6386-0995
[ E-mail] [email protected]
[ U R L ] http://www.blitzmenow.com/