ケモゲノミクスと分子シミュレーションの 融合から、新しい計算創薬が生まれる

神戸港内に浮かぶ人工島、ポートアイランド。その中にある理化学研究所計算科学研究機構に設置されたスーパーコンピュータ「京」を利用して、産学官の連携によるインシリコ創薬の基盤技術の開発が進められている。その研究代表者である、京都大学医学研究科教授の奥野恭史氏に、ケモゲノミクスと計算科学の融合による創薬研究の目指す先について伺った。
超高速の演算が導く2つの創薬アプローチ
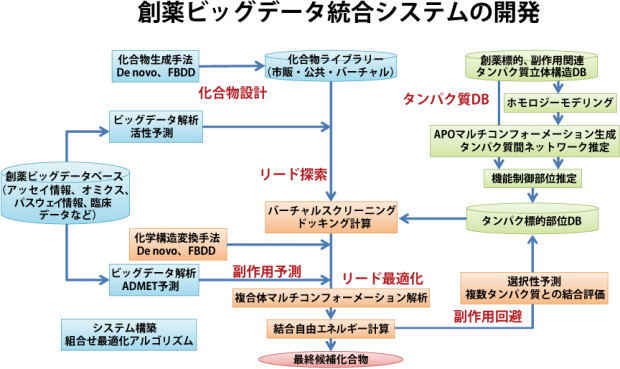
奥野氏が今、京を活用して進めている創薬へのアプローチは2つある。ひとつはビッグデータ解析によるタンパク質-化合物間の結合予測だ。すでに結合することが実験的に明らかなタンパク質と化合物の組み合わせは多数ある。それらを解析して共通項を探ることで、新たな結合ペアを見つけ出そうという試みである。具体的には、低分子化合物が持つ分子量や極性、logP(疎水性の度合いを表す係数)、各種官能基の数といったパラメータと、タンパク質のアミノ酸配列をそれぞれ数値の行列として記述する。そして、低分子の行列とタンパク質の行列とを組み合わせたものについて、結合強度に関する実験データを元に点数付けを行う。その中から機械学習により、高得点に寄与する数値のパターン、すなわち分子構造やアミノ酸配列のパターンを見出すのだ。
すでにGPCRやキナーゼをターゲットとした12万の結合ペアのデータを元に、京を用いた計算により631の疾患関連タンパク質と3000万種類の化合物との間の18.3億ペアについて結合予測を実施。新たなターゲティング分子候補を多数見出している。
もうひとつのアプローチは、分子動力学計算によるシミュレーションだ。従来のタンパク質の立体構造を元にしたドッキングシミュレーションは、活性部位にパズルのようにカチッとはまる化合物を探し出す。しかし実際の環境下では、分子を構成する各原子がランダムに揺らぐことで、タンパク質、低分子それぞれの構造自体が動き続けているため、固定化された立体パズルを解くように簡単なものではないのだ。奥野氏は京の演算能力を活かして原子の動きを計算し、より正確な結合シミュレーションを行う。これにより、従来の方法では予測した化合物の5%しか実際に活性を示さなかったのに対し、70%を目標にできるレベルの予測精度を実現している。
実用化への開拓を進め、5年後の革新を目指す
スパコンを活用した新たなインシリコ創薬の手法を開発する一方で、奥野氏が今直面しているのが、「創薬の現場で実際に利用する」に際しての課題だという。今、製薬企業の中ではハイスループット装置を用いて化合物スクリーニングを行うのは当たり前になっている。製薬企業の間で研究開発フローが異なる中、どこまでを計算で進め、どこから実験に切り替えると効率が上がるのか、一社一社に最適化が必要なのだ。「精度を上げれば、それだけ計算時間が延びてしまいます。実用に耐えうる精度の下限について、製薬企業の計算科学者や実験者、マネージャーとの議論を続けています」。
現場で使えないと意味が無い。そう話す奥野氏は、京の産業利用枠「新薬開発を加速する『京』インシリコ創薬基盤の構築」プロジェクトの代表として20社以上の製薬企業とのコミュニケーションを進めつつ、2020年に完成予定の次世代スパコン(ポスト京)の開発にも携わっている。「京が開発された頃には、分子の挙動計算のスペック向上に重きが置かれていました。一方、実用を目指すためには、タンパク質間の相互作用を含む機能のシミュレーションや、結合候補化合物デザインまでを含めた総合的な計算性能を設計する必要があります」。特に創薬の場合、ターゲットタンパク質に結合させる分子の構造を変化させた時に結合性がどう変わるか、リアルタイムに計算をできるのが良い。将来的に分子動力学シミュレーションによる結合力の評価が十分な信頼性を獲得できれば、冒頭に挙げたビッグデータ解析と連結し、コンピュータ自身が低分子化合物のシミュレーションと評価のサイクルを回せるかもしれない。ターゲットのアミノ酸配列を渡せば、薬剤候補物質を結合力が高い順から挙げてくれるシステムが実現できる可能性もあるのだ。
京が完成したのは2012年7月。3年経った現在でもまだ製薬会社が現場利用するのに苦労しているが、計算能力で京の数十倍になるというポスト京は、最初から実用化を視野に入れ、この夏に開発が始まる。「東京オリンピックの年、インシリコ創薬は神戸の地で次の一歩を踏み出せると思います」と奥野氏は話す。
臨床データと分子計算をつなげる
奥野氏は2014年の春に、薬学研究科から医学研究科に移った。その時に新たに始めたのが、臨床ビッグデータの解析だ。がん患者のゲノムデータやマイクロアレイによる発現データを解析しつつ、一方で臨床データのみから、例えば血中の好中球数変動などの計算モデルを構築している。「臨床で得られる数値の裏には、必ず分子の変動がある。計算モデルとオミクスの変化とを結びつけたいですね」。それに加えて、インシリコ創薬により転写因子等の活性制御ができる低分子を設計できれば……もしかしたら、臨床の数値を薬剤で自在に制御できる時代が来るかもしれない。
ポスト京では計算能力の向上に合わせ、高分子化合物の結合シミュレーションも視野に入れている。その一方で奥野氏は、あくまで低分子にこだわることで、医薬の新しい道が拓けるのでは、とも考えている。「抗体医薬に代表される高分子薬は、どうしても高コストで、医療費の増大につながります。例えば計算によって、ターゲットタンパク質に対して抗体と同じ影響を与える低分子化合物を設計できたら、すばらしいと思いませんか?」
近年、世界の医薬品市場の売上上位の多くを抗体医薬が占めるようになり、それらは全て海外の製薬メーカーの商品だ。その状況を計算科学によって塗り替えて、「日本の製薬企業はなぜこんなにいい薬を創れるんだ、と言われる世界を作りたいですよね」と、ニヤリとしながら話す。
まだ京が開発中だった数年前、「2位じゃダメなんですか」と言われたこともある。ダメなんです。世界最速のスパコンを、知恵ある研究者と企業が存分に活用することで、拓ける世界があるのだ。 (文・西山 哲史)