【特集】化学と生物学の狭間で生まれる新しい医薬品 -DDSと人工抗体は次の医薬品市場の鍵となるか-

2010年前後で大型医薬品が一斉に特許切れを起こす「2010年問題」が、そろそろ終盤にさしかかろうとしている。2010年時点で世界売上高1位だったPfizer/アステラスが販売するリピトール(一般名:アトルバスタチン)のジェネリックが2011年11月に登場し、2位のプラビックスもすでに特許切れを起こした。大きなうねりをもって変動する医薬品市場。新薬上市のための新たな開発が進められる中、さらに遠い先に医薬品となるかもしれない、新しい技術の基礎研究が各所で進められている。今回は中でも、ここ5年で市場規模が2倍に成長した「ドラッグ・デリバリー・システム(DDS)」と、同じく急拡大する抗体医薬市場に今後台頭するであろう「人工抗体」に注目しよう。
ラインナップの多様化と機能付加が進むDDS
多様化するDDS技術
組織や器官、分子にターゲットを絞り薬剤を届けるDDSは、薬の効果を最大化し副作用を低減する技術として研究開発が進められ、その市場規模も高い成長率を保ち続けている。世界の先進DDS市場は、2011年にはおよそ1,379億米ドル規模、その後年間成長率5%で拡大し、2016年までに1,756億米ドルに達すると予測されている1)。多くの薬が特許切れを起こす中、ジェネリック医薬品への対策として、DDSによって既存薬を別の場所に送ることで新しい薬理効果を持たせ、優位性を保とうという動きもある。
近年、ナノテクノロジーや巨大分子合成技術の発展などを背景に、様々なDDSが研究されてきた。一例として外用薬(飲用・注射以外の手段で投与する薬剤)のための新しい技術を一覧してみよう(表1)。皮膚や粘膜を通過して薬剤分子を導入するために、ArchaeosomesやProteosomes、Virosomesのように生体高分子を利用したものもあれば、AquasomesやGenosomesのように人工材料によるものなど、様々な方向性から開発が進められているのが分かる。
[table style=”1″]
| キャリア | 特徴 |
|---|---|
| Archaeosomes | 古細菌が持つグリセロ脂質で構成されたリポソーム。物理的・化学的に極めて安定で、アジュバント活性があるためワクチン用DDSとして期待されている。 |
| Aquasomes | 自己集合型の3層のセラミックナノ粒子で、ポリヒドロキシ化合物のガラス質の層が中心に充填されている。アジュバンド活性もある。 |
| Discosomes | 非イオン化界面活性剤により可溶化されたニオソーム(二分子膜の閉鎖小胞体)。小胞表面のリガンドにより、薬剤標的に対し指向性を持つことが可能。 |
| Cryptosomes | フォスファチジルコリンとフォスファチジルエタノールアミンのポリオキシエチレン誘導体により表面をコーティングされた脂質小胞。小胞表面のリガンドにより、薬剤標的に対し指向性を持つことが可能。 |
| Enzymosomes | リポソームに酵素を共有結合で固定化もしくは表面に結合させることで、極小の生物環境を作りだしている。腫瘍細胞に対する特異的なデリバリーシステムとして期待される。 |
| Emulsomes | 無極性のコア分子に脂質が結合した、極小サイズの生体接着性ナノエマルジョン。難水溶性の薬剤の非経口投与システムとして使用される。 |
| Ethosomes | リン脂質、エタノール、水と透過促進剤からなり、柔らかく成形のしやすい脂質小胞。皮膚の深層まで浸透することが可能。 |
| Genosomes | 遺伝子導入のための陽イオン性脂質の人工的な高分子複合体。生分解性であるが血流内ではきわめて安定。細胞特異的な遺伝子導入に用いられる。 |
| Erythrosomes (Proteoliposomes) |
ヒトの赤血球の細胞骨格で補強された脂質二重膜。高分子薬剤の場合に用いられる。 |
| Photosomes | リポソームにフォトリアーゼ(光回復酵素)を閉じ込めており、光刺激の変化により薬剤を放出する。光線力学的治療法に用いられる。 |
| Novasomes | ジラウリン酸グリセリル、コレステロール、ポリオキシエチレンステアリルエーテルが7:15:28の重量比で含まれている。毛嚢脂腺に薬剤を運ぶのに有効。 |
| Transferosomes (elastic liposomes) |
非侵襲で皮膚の深層や血流に薬剤を届ける目的に特化した、柔らかく成形のしやすい脂質キャリア。 |
| Vesosomes | 飽和リン脂質にエタノールを加え、互いに噛みあうように二層になった二重膜構造をとる。血清中でも分解されにくく、内容物を保護できる。 |
| Proteosomes | 高分子量の酵素複合体で、その複合体構造に依存する酵素活性を持つ。タンパク質キャリアとして働くと同時に、アジュバンド活性を持つことがある。 |
| Virosomes | レトロウイルスの脂質二重膜にウイルスの糖タンパク質が埋め込まれたもので、アジュバントとして使用できる。 |
[/table]
表1 外用薬向けのDDS技術。
Tadwee et al. (2011). Advances in Topical Drug Delivery System: A Review. IJPRAS. 1 (1): 14-23 より
巨大樹状分子に薬剤を内包する
一方、すでに市販品も出ており、かつ盛んに研究開発が進められているものとしてデンドリマーが挙げられるだろう。デンドリマーとは中心から規則的に分岐した構造を持つ樹状高分子で、コア(core)と呼ばれる中心分子と、デンドロン(dendron)と呼ばれる分枝する側鎖部分から構成される。デンドロンの分枝により、層を重ねるほど分子は巨大となり、まるで樹木のような構造になる(図1a)。
DDSでは(1)薬剤を内部に保持できる、(2)ターゲットを認識し、そこに集まる、(3)ターゲット内部に入ると薬剤を放出する、(4)ターゲット以外の場所では薬剤を放出しない、といったことが要件となる。デンドリマーは、その内部空間に化合物やタンパク質を内包することができ、かつデンドロン末端が官能基となりPEGなどによる修飾が可能なために、生体適合性や特異的吸着といった性質を加えることができる。薬剤を内包するために共有結合を介さず、分子間相互作用により空間に閉じ込めるため、混合するだけで汎用性の高い輸送材として使えることも特徴だ。
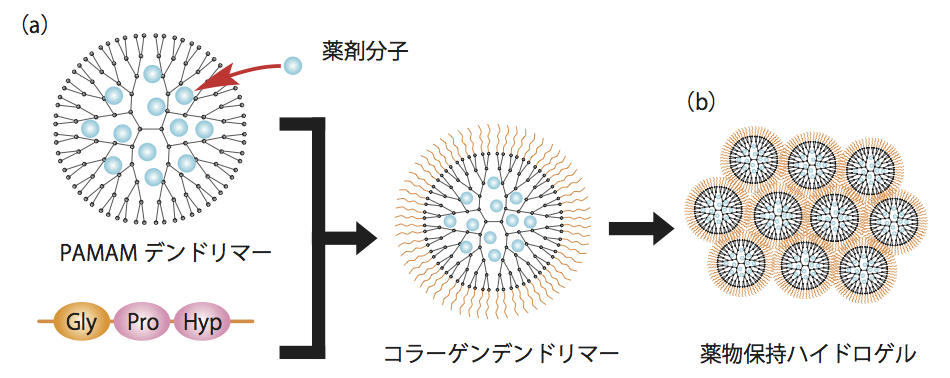
図1 (a)ポリアミドアミンデンドリマーは内部空間に薬剤分子を内包できる。 (b)コラーゲンデンドリマーは熱により可逆的に凝集・乖離が可能。
薬剤放出タイミングをコントロールする
大阪府立大学の児島千恵氏(特別講師)は、このデンドリマーにコラーゲン分子を結合させ、薬剤放出のタイミングをコントロールする技術を開発している。そのひとつは、温度応答による放出だ。一般的なデンドリマーであるポリアミドアミン(PAMAM)デンドリマーの表面に、コラーゲンに特徴的なグリシン-プロリン-ヒドロキシプロリンの繰り返し構造を持つペプチドを結合させる。通常、この繰り返しペプチドのみではコラーゲンのような三重ヘリックスを作らないが、デンドリマー末端に結合させることで密度が高まり、三重ヘリックス構造を誘起させることができる。それにより、多数のコラーゲンデンドリマーが集積したゲル様構造を形成するのだ(図1b)。このゲルは、熱によって可逆的にヘリックス構造を解くことができる2)。それにより、温度制御により薬剤放出を制御できる可能性があるという。
また児島氏は、I型およびIV型コラーゲンをデンドリマーに結合したコラーゲンハイブリッドゲルを用いて、がんの転移をトリガーとして薬剤を放出するシステムの開発も進めている。がん細胞は、マトリックスメタロプロテアーゼ(MMP)を分泌してコラーゲンを含む細胞外基質を分解しながら血管へと浸潤し、全身に転移する。抗がん剤を内包したコラーゲンハイブリッドゲル上で乳がん細胞の高転移性株(MDA-MB-231細胞)、低転移性株(MCF-7細胞)を培養し、細胞毒性を評価したところ、高転移性株に対して選択的な毒性を示したのだ3)。
児島氏の研究は「、癌転移に呼応して作用する新規DDS材料の転移抑制効果の検証」というテーマで科学技術振興機構の研究成果最適展開支援プログラム(a-step)に採択されている。今はまだ「シーズ」の段階だが、今後製薬企業との協業などにより芽を出し、実用化まで至れるよう期待したい。
安く、早く、高機能を求める人工抗体
急拡大する抗体医薬市場と人工抗体への期待
世界の大型医薬品市場において、2010年の売上高トップ10のうち4品目は抗体医薬となっている。しかもそれらは前年度と比較して10~20%の伸び率を示し、この分野の将来性を示している。抗体医薬は標的分子に対する高い特異性と生体内安定性の高さから従来の低分子医薬を大きく上回る治療効果を示すため、製薬企業で積極的に開発が進められている。例えば国内でも抗体医薬に強みを持つ中外製薬株式会社では、25個あるパイプラインのうち12個は抗体医薬となっている(ロシュ共同開発品を含む、2012年2月現在)。一方で、年間数百万円にもなる薬価の高さが問題として存在する。低分子化合物と比較して高い開発・量産コストが薬価に反映されているためだ。患者の負担を減らすため、また保険料の増大を防ぐために、抗体医薬と同様の特異性を持ちながら、開発や量産にかかる費用を低減する新たな「人工抗体」の開発が期待されている。
変化しつつある人工抗体の枠組み
もともと人工抗体という概念は、抗体が持つY字型の構造のうち、抗原と結合する先端部(VH/VLドメインの複合体)だけを合成して利用するというものだった。このドメインをコードするcDNAの中にある、抗原との相補性を決定する領域(complementarity-determining region:CDR)に人為的な改変を加えて多様な低分子抗体を作ることで、全体を作るよりも少ないタンパク質生産によって薬剤を作る。また、インターロイキン等の免疫賦活物質を結合させることで効果を高めることで、投与量を減らす。そのような言わば「人工改変型抗体」が、人工抗体だったのだ。
一方で最近、構造ではなく、「特異的な分子に対して高い親和性を持つ」という機能を模倣した分子を人工合成しようというアプローチが進んでいる。もともと抗体の多様性と特異性は、利根川進氏が発見したVDJ領域におけるゲノム組換えと、V領域で高頻度に起こる塩基変異により生まれる。膨大な多様性に富むCDRのアミノ酸配列が様々な立体構造を作り、多種多様な抗原に対して適合できる抗体分子ライブラリを生んでいるのだ。それに対し、新しい人工抗体の考え方には、同様に多様なアミノ酸配列のライブラリを化学合成によって構築するアプローチと、標的抗原に特異的に結合する立体構造を持った化合物を合成するアプローチとがある。これらに共通する利点は、いずれも化学合成によって量産するために製造コストを低く抑えられるという点だ。
ランダムなアミノ酸配列ライブラリで抗原を捕まえる
アミノ酸が複数結合したペプチドは、必ず何かのタンパク質と相互作用する。この考えを元に、アリゾナ州立大学Stephen Albert Johnstonらは合成ペプチドを用いて人工抗体ライブラリを作るシステム“Synbody”(=Synthetic Antibody)を構築した。Synbodyはランダムな配列を持つ20残基のペプチド2つがリンカー分子で結合した構造をしている。タンパク質との相互作用において、ひとつひとつのペプチドは特異性が低いが、それが2つ繋がることによって特異性高くターゲットのタンパク質に結合するようになる、という予測のもとに彼らは研究を行った4)。この考えをテストするため、最初のSynbodyとして図2のような化合物が合成された。これを8,303個のタンパク質を含むプロテインアレイに反応させ、結合するものを調べた。そこでAKT1タンパク質の2つのアイソフォームに結合することが認められたことから、その相互作用について、Biacore、ウエスタンブロット、免疫沈降などで解析を行うと、驚くべきことに市販されている抗AKT1モノクローナル抗体と遜色のない力価を持っていたのだ。たった一度のスクリーニングで高力価の人工抗体を得られるSynbodyは、分子としての安定性も高いという。またリンカーとなる化合物の末端にビオチンや蛍光分子を結合できるなど、アプリケーションとしての汎用性もある。
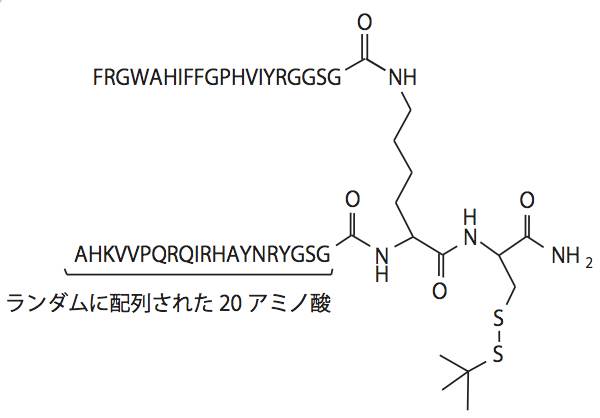
図2 最初に作られたSynbodyの構造
この技術を使って診断、治療に使える人工抗体を作り上げようと、彼らはベンチャー企業Synbody Biotechnology, Inc.(http://www.synbodybio.com/)を立ち上げている。まだ提携先を探している段階のようだが、2010年にはアメリカ国防高等研究計画書(DARPA)から兵士の感染症対策のために530万ドルの助成を受けた。今後、彼らがどんな成果を生み出すか、注目したい。
抗原を鋳型にして成型するプラスチック抗体
一方、九州大学助教の星野友氏が創り上げたコンセプトは、自然の抗体が持ちSynbodyを含む多くの人工抗体でも踏襲された「多様なライブラリを用意し、抗原に適合するものをピックアップする」という考え方とは真逆のものだ。星野氏は、ナノサイズの化合物モノマーを抗原の周辺で重合させ、その後抗原を除去することで、ぴったりと結合する化合物ポリマーを得るという発想で人工抗体を合成した(図3、星野氏はこれをプラスチック抗体と呼ぶ)。モノマーとして利用されたのはN-イソプロピルアクリルアミド(NIPAm)やN-tertブチルアクリルアミド(TBAm)、N,N’-メチレンビスアクリルアミド(Bis)、アクリル酸(AA)だ。これらを26アミノ酸からなるハチ毒であるメリチン(Melittin)と混合し、過硫酸アンモニウムとTEMEDを用いて重合させる。その後メリチンを除去し、残ったポリマー自体の毒性およびメリチン中和活性が調べられた。メリチンは通常、高濃度で生体に入ると細胞を溶解し、腎臓障害や心臓の合併症を引き起こし、死に至らしめる。この研究でもコントロールとしてメリチンのみ投与したマウスでは100%が死亡したが、抗メリチン-プラスチック抗体をあわせて投与したマウスでは、腹膜炎や体重減少が抑えられ、死亡率は半減した。蛍光ラベルしたメリチンの挙動を追うと、プラスチック抗体が結合したメリチンは肝臓へと蓄積し、そこでマクロファージに取り込まれていることが確認された5)。その後、星野氏は第一級アミンやカルボキシル酸を含む様々なモノマーを材料としてプラスチック抗体を作り、重合のしやすさや細胞毒性(中には溶血作用を促進する組成もあった)、凝集のしやすさなど様々な性質を調べた。その結果、負電荷を持たない疎水性のものでは凝集し、細胞毒性を持つことが分かった。このことにより、今はまだ負電荷を持つ疎水性の毒物質(リポポリサッカライドなど)に対しては適切なプラスチック抗体を作ることはできないが、水素結合やファンデルワールス力によって結合するようなモノマーを利用できれば、この問題はクリアできる可能性があると述べている6)。
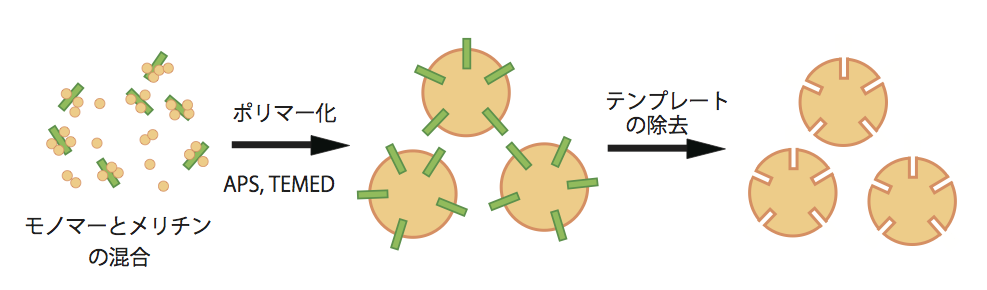
図3 プラスチック抗体の材料となるモノマーと抗原を混合し、 過硫酸アンモニウムとTEMEDで重合させる。そして抗原を除去すれば、 プラスチック抗体が完成する。
プラスチック抗体のアプローチは、従来の抗体医薬では不可能だった、ターゲット分子を元にした抗体設計を可能にするかもしれない。多様なライブラリの保管やスクリーニングの手間を無くすことで、コスト、スピードの点で大きなアドバンテージがあるはずだ。前述の児島氏と同じく、星野氏も研究成果最適展開支援プログラム(a-step)に採択された。そのテーマは「プラスチック抗体の高速大量精製システムの開発」。毒物やウイルスに対して最適な抗体の高速大量生産方法が確立されれば、既存薬の薬価低減、新たな抗体医薬の創出、パンデミック対策など、数多くの可能性を秘めているだろう。
1) Advanced Drug Delivery Systems: Technologies and Global Markets, 2011年10月 , BCC Research
2) Kojima et al. (2011). Preparation of heat-induced artificial collagen gels based on collagen-mimetic dendrimers. Soft Matter 7. 8991-8997.
3) 科学研究費補助金研究成果報告書 課題番号:19700406 「転移性乳癌細胞を標的とし た新規ドラッグデリバリーシステムの構築」
4) Diehnelt et al. (2010). Discovery of High-Affinity Protein Binding Ligands ‒ Backwards. PLoS ONE. 5(5): e10728.
5) Hoshino et al. (2010). Recognition, Neutralization, and Clearance of Target Peptides in the Bloodstream of Living Mice by Molecularly Imprinted Polymer Nanoparticles: A Plastic Antibody. J. Am. Chem. Soc. 132: 6644-6645.
6) Hoshino et al. (2011). The rational design of a synthetic polymer nanoparticle that neutralizes a toxic peptide in vivo. PNAS. 109 (1): 33-38.
