分子間相互作用解析の原理を追う
分子生物学の研究の目的は、突き詰めれば生体内に存在する分子と分子の間の相互作用すべてを解明することだと言えるだろう。あるDNAの塩基配列に転写因子が結合し、作られたRNAにリボソームが結合する。移行シグナル部が合成されるとシグナル認識粒子が結合して翻訳を停止し、小胞体膜上の受容体に結合してタンパク質を小胞体内部に産み落とす。そしてゴルジ体を経由して細胞表面に送り出され、別の細胞の表面タンパク質と相互作用し、よりマクロなレベルでの現象につながっていく。
生命現象は、数多くの分子と分子が結合し、解離することで成り立っている。本特集では、その分子間相互作用を解析するための装置に着目し、いかなる原理で分子の出会いと別れを解析しているのかを見ていくことにする。
蛍光相互相関分光法
Fluorescence Cross-Correlation Spectroscopy
蛍光相関分光法(FCS)は、共焦点レーザーを用いて蛍光標識された分子のブラウン運動を観測し、相互作用を解析する方法である。溶液中の分子は、ブラウン運動によって自由に移動している。その平均速度は、一定温度の状況であれば小さな分子ほど速く、大きな分子ほど遅くなる。そのため、蛍光標識された分子が共焦点領域を通過する際の蛍光強度のゆらぎの速さから分子の運動速度を求め、分子の大きさを推測することができるのだ。
蛍光相互相間分光法(FCCS)では、相互作用するかどうかを調べたい2つの分子を異なる色の蛍光で標識し、共焦点領域での2つの色のゆらぎを測定する。もし分子すべてが互いに結合していれば、そのゆらぎは完全に一致するはずである。2分子がどの程度結合しているかに比例してゆらぎの相関が高まるため、結合強度を定量的に解析することが可能だ。
この解析法の利点は、蛍光で測定するために感度が高いこと(共焦点領域を通過さえすれば、1分子同士の結合も測定可能)、そして片方の分子を基盤に結合させる必要がなく、蛍光標識をできればどのような分子も測定できることだ。その反面、測定には蛍光標識が必要なこと、そのことが相互作用に影響を与えうることを認識しておく必要がある。
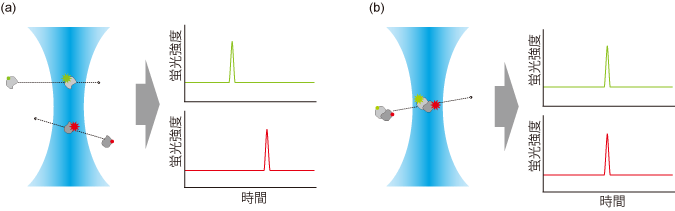
[図1]蛍光相互相関分光法(FCCS)の概念図
(a)2種類の蛍光標識された分子(図では緑色と赤色)の相互作用がなく、独立に共焦点領域(水色)を通過すると、蛍光シグナルはそれぞれの通過タイミングで検出される。
(b)一方、2つの分子が結合していると、蛍光シグナルは同時に検出される。2つの蛍光シグナルの相関の強さによって、相互作用の強さを定量的に検出することができる。
等温滴定型熱測定法
Isothermal Titration Calorimetry
等温滴定型熱測定法(ITC)では、混ぜあわせた溶液中に含まれる分子同士の相互作用に伴う微小な熱変化(発熱変化または吸熱変化)を直接測定する。ITCの装置内部には試料セルと参照セルがあり、相互作用に関わる片方の分子の溶液を試料セルにセットする。一定温度に保たれた試料セル中の溶液に対して、滴定シリンジ内のリガンド溶液を滴定し、相互作用を起こすと結合量に比例した熱変化が起こる。一定温度に保ち続ける参照セルとの温度差を測定し、その変化を捉えるのだ。リガンド溶液の滴下を続けると、徐々に相互作用は飽和して熱変化が減少し、最終的に観測されるのは希釈熱のみになる。
ITCは熱をプローブとして相互作用を解析するため、標的分子の化学的修飾や物理的固定化の必要がなく、またタンパク質同士、タンパク質と低分子、低分子同士などあらゆる分子間相互作用の解析が可能だ。また、一度の測定で相互作用の結合定数(Ka)や結合比(n)、エントロピー変化(ΔS)、エンタルピー変化(ΔH)を求めることができる。
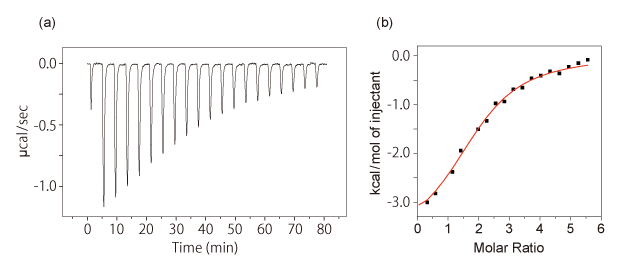
[図2]等温滴定型熱測定法の典型的データ
(a)試料セル中の溶液に対してリガンド溶液を滴定すると、熱変化が観測される。滴定を続けると試料セル中のフリーなホスト分子の濃度が低下するため、熱の変化量は徐々に小さくなっていく。
(b)ホスト分子とリガンドとの濃度比と滴定による温度変化をプロットして解析を行う。
水晶振動子マイクロバランス測定法
Quarts Crystal Microbalance
水晶振動子マイクロバランス測定法(QCM)は、非常に薄い水晶板(水晶振動子)に交流電圧を与えると、厚みに反比例した一定周波数で振動することを利用した解析だ。表面にホスト分子を固定化すると、振動子の平均膜厚がわずかに変化するため、振動周波数が変化する。そこにゲスト分子を加えると、結合量に応じてさらに振動周波数が変化する。そのため、ゲスト分子の濃度に応じて振動周波数がどのように変化するかを測定することで、結合強度を調べることができる。
この解析では、ゲスト分子の濃度を変えて逐次結合させ、その際の振動周波数変化を得ることで、結合速度定数(ka)、解離速度定数(kd)、解離定数(KD)を計算することができる。装置にはフロー系とキュベット系があり、フロー系の場合、解離反応を直接観測でき、反応を自動化できるというメリットがある。一方、キュベット系では長時間の計測が可能であり、測定溶液のサンプリングができるため、ファージディスプレイ法の検出等に利用されている。
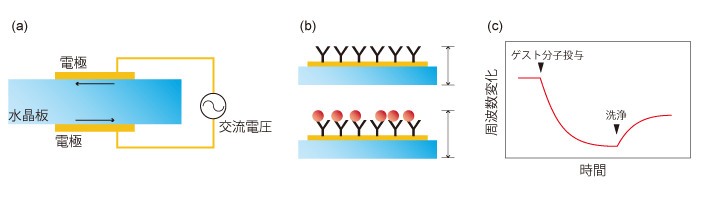
[図3]水晶振動子マイクロバランス測定法の概要
(a)2枚の電極を通じて間に挟まれた水晶板に交流電圧をかけると、水晶板に結晶方向と平行のずり振動が生じる。
(b)水晶板の振動周波数は厚みに反比例しており、電極上に固定化されたホスト分子にゲスト分子が相互作用すると、周波数が低下する。
(c)フロー系の装置では、ゲスト分子やバッファーを加えた際の周波数変化のグラフの傾きかた、結合速度や解離速度を計測することが可能だ。
反射型干渉分光法
Reflectometric Interference Spectroscopy
反射型干渉分光法(RIfS)は、測定対象の分子を結合させたチップ表面での光の反射を観測することにより、相互作用を解析する方法である。センサーチップの表面近くはSiO2、Ta2O5というように、屈折率が異なる素材がサンドイッチ状に重なっている。また、一番表側にあるSiO2層は、抗体やNi-NTA、Protein Gなどが固定化できるようになっている。このセンサー内部から白色光を入射させると、その一部は屈折率が変わる界面部分で反射する。SiO2からTa2O5への界面、表面分子から液相への界面などで反射した光同士が干渉して強めあったり弱めあったりするので、波長ごとの反射光の強度分布(スペクトル)を得ることができる。この時、例えばセンサー表面に固定化した抗体に抗原分子がどの程度結合しているかによって反射光スペクトルが変化するため、相互作用の解析ができるという原理だ。
この方法は、結合速度定数(ka)、解離速度定数(kd)そして解離速度(KD)をラベルフリーかつリアルタイムに計測することができる。また測定に影響を与える光路がチップ内部と表面に結合した分子付近に限られるため、原理的に測定環境による影響を受けにくく、再現性が高いことも利点だ。この原理を採用する日本ポールのfortéBIOシリーズ(本シリーズではこの技術をBioLayer Interferometry;BLIと呼んでいる)では、様々な抗体や一般的なタグに結合する分子をあらかじめ固定化したセンサーチップを各種揃えており、クルードサンプルにも対応した相互作用解析技術を提供している。
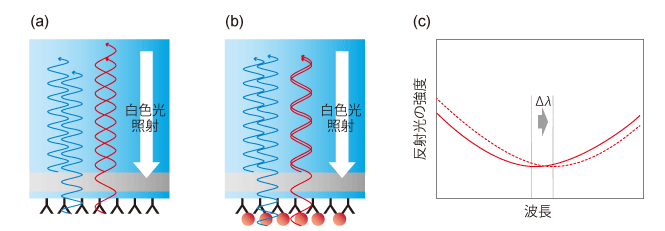
[図4]反射型干渉分光法の概要
(a)センサーチップの裏側から白色光を照射すると、屈折率が変化する界面で一部の光が反射する。それぞれの界面で反射した光同士が干渉を起こし、強めあったり打ち消しあったりする(ここでは青線で示す光は強めあい、赤線で示す光は打ち消しあうことになる)。
(b)センサー表面に固定化した分子に他の分子が結合すると、反射の界面位置が変化する。それによって、反射光の干渉の仕方も変わる。
(c)反射光のスペクトル上で、ピークのシフト(Δλ)が起こる。ここでは反射光が干渉により減衰している部分のピークを示した。
表面プラズモン共鳴法
Surface Plasmon Resonance
表面プラズモン共鳴(SPR)による相互作用解析は、1990年にBiacore(当時はPharmacia Biosensor社)が世界で初めて解析装置に採用した、歴史ある技術だ。センサーチップを構成するプリズムに、光が全反射するように入射させる。すると、エバネッセント光と呼ばれる光がわずか100nm前後の深さのみ、プリズムから染み出してくる。この光をプリズム表面に蒸着された金属薄膜と共鳴し、反射光は大きく減衰する。SPRとは、この現象を指す。SPRが起きるのは特定の入射角の光のみであり、その角度は金属薄膜部の状態によって変化する。そのため、表面にホスト分子を固定化し、流路中にゲスト分子を流して、どの入射角で反射光が減衰するかを検出することで、結合の強度を調べることができる。また、入射角を一定にし、流路中にゲスト分子溶液とバッファーを順番に流して反射光強度の時間変化を測定することで、結合速度定数(ka)、解離速度定数(kd)や解離速度(KD)を測ることができる。
この技術の強みは、得られる情報の多さ、扱えるサンプル種の多様さ、再現性の高さに加え、何よりもその実績の多さが挙げられるだろう。Biacoreは相互作用解析装置の代表格と言って間違いない。
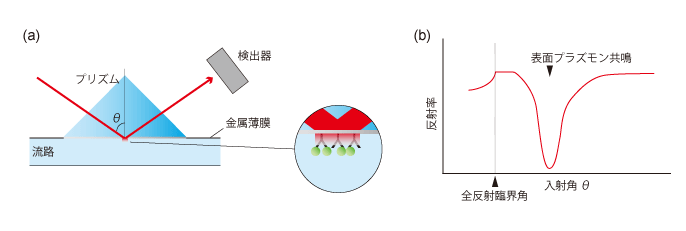
[図5]表面プラズモン共鳴法の概要
(a)表面プラズモン共鳴装置のセンサーチップ周辺概略図。流路中に設置されたセンサー部の裏にはプリズムが配置されており、その裏側からレーザーが照射される。ある範囲の入射角では全反射が起こり、その時エバネッセント光が流路側に漏れ出す。
(b)特定の入射角θの時に表面プラズモン共鳴が起き、反射光が大きく減衰する。この角度はチップ表面の状態によって異なり、流路を流れるゲスト分子がセンサーチップに固定化されたホスト分子に結合すると変化する。この変化を捉えることで、分子の相互作用を検出できる。
ここまで、5つの相互作用解析原理を見てきた。YeastTwoHybridや免疫沈降法といったウェットな実験手法では相互作用の有無という情報しか得られないのに対し、これらの原理を採用した解析装置を使えば、結合強度や結合速度といった情報を得ることができ、さらに実験時間の短縮、再現性の向上もできる。
最後に、これらの解析装置の国内取扱いメーカー、代理店の一例を表に示す。Biacore一択だった以前と比べて選択肢が広がり、より安価な機器も揃っていているので、導入を検討してみてはいかがだろうか。
