片手サイズの分子間相互作用解析装置がバイオものづくりを支える from 「BIO GARAGE」vol.22

分子どうしの相互作用は、その分子の機能に直接的に関与しうる現象であるため、様々な解析手法が開発されてきた。この分野に2013年に登場したBLItzの特徴のひとつが、少ないサンプルボリュームで分子間相互作用を速度論的に解析できることだ。そしてこの特徴を最大限に活かして生体物質の応用範囲を広げようという研究が進んでいる。小スケールでの分子間相互作用解析装置をずっと探していたという理化学研究所の鵜澤尊規氏に、実際の使用例を伺った。
User interview

2006年 京都大学大学院工学研究科博士課程修了 博士(工学)
理化学研究所基礎科学特別研究員および研究員を得て2014年より現職
生体分子の可能性に魅せられて
生物が持つ高分子はその多機能性で知られる。例えば、20 種類のアミノ酸で構成されるタンパク質は、順番や長さによって構造や機能が決まり、様々な場面で活用されていることはご存知の通りだ。鵜澤氏は、タンパク質が自発的に構造を形成する過程を観察する基礎研究からキャリアをスタートした。基礎研究を通して生体分子の可能性の広さを感じ、今では様々な分子から新しい材料や機能を開発することも目指している。それが同氏の所属する研究室が標榜する、バイオの力を使って新しい材料を作る、バイオものづくりだ。
少サンプルで分子間相互作用を解析可能なBLItz
鵜澤氏は、将来的に光駆動型のRNA酵素を作ることを目指して、光を電子に変えることのできるルテニウム錯体に結合するRNA分子を探索している。ルテニウム錯体を化学修飾したマグネチックビーズを様々な配列のRNAプールに浸し、結合したRNAを回収する。そのRNAを増幅したものを新しいRNAプールとして、再びビーズで釣り上げる。このサイクルを複数回繰り返すことにより、ルテニウム錯体に結合しやすいRNA分子が濃縮されるのだ。このSELEXと呼ばれる試験管内選択法を通して得られるRNAの候補配列が、実際にルテニウム錯体に結合するかどうかを確認するために、4μlのRNA量で分析可能なBLItzを活用している。
BLItzで候補となるRNA配列とルテニウム錯体の結合を測定したところ、ひとつだけ他のRNA配列よりも100 倍程度強く結合するRNA配列が見つかった。鵜澤氏は、このRNA配列を大量に合成して他の結合評価方法でも確かめるつもりだと話す。全ての候補配列を大量合成しなくて済むため、サンプル量や費用を抑えることが可能なBLItzの存在は大きい。
分子を進化させることで可能性は更に広がる
現在、RNAだけでなく10から15アミノ酸のペプチドについても同様の手法を使おうとしている鵜澤氏。例えば、蛍光色素のような非天然のアミノ酸をペプチドに組み込むことで、ウイルスに結合すると蛍光を発する機能を持たせたペプチドをつくり、インフルエンザ検査に応用できるのではないかと考えている。
RNAやペプチドなどの生体分子が研究室で見せる進化は、地球の歴史の上で起きた分子進化を凌駕した、新しい生体分子を見せてくれることだろう。
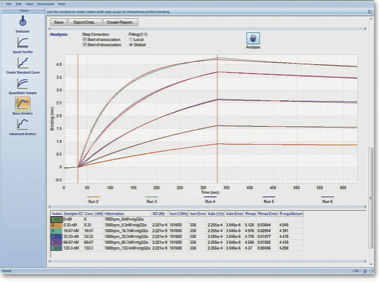
小型、簡便、強力な相互作用アッセイ
BLItzは手のひらに乗るほどの小型サイズながら、簡便にラベルフリー、リアルタイムの分子間相互作用測定が可能だ。使用の際は、測定部のアームを上げて専用のバイオセンサーを設置し、4μlのサンプル溶液をセンサーに浸せば測定が開始される(図1)。例えば自作の抗体と抗原とのアフィニティを見たい場合は、まず抗体溶液をウェルに入れ、ProteinAまたはGを固定化したセンサーを浸す。結合がプラトーに達したら、再びアームを上げてウェルを洗浄し、抗原溶液を加えてアームを下げるだけで良い。それらにかかる時間はわずか数分だ。マイクロ流路を使用しないBLItzでは、サンプルが詰まってしまうことがないため、細胞抽出液や血清などクルードサンプルの使用も可能であることも大きな特徴といえる。
肝はバイオセンサーにあり
測定の仕組みは、Biolayer Interferometry(BLI)という技術だ。バイオセンサーは、先端の表面近くに屈折率の異なるSiO₂、Ta₂O₅がサンドイッチ状に重なっており、一番先端のSiO₂層には、抗体やNi-NTA、ProteinGなどが固定化されている。このセンサー内部から白色光を通すと、その一部はSiO₂とTa₂O₅、表面分子と液相などの、屈折率が変わる界面で反射し、また反射光同士は互いに干渉する。センサー表面の抗体等に他の分子が結合すると、タンパク質が作る層の厚みがごくわずかに変化し、反射光のスペクトルが変化する(図2)。BLItzはこのスペクトルを解析し、簡便な相互作用解析を可能にしているのだ(図3)。計測に用いる光が通過するのはバイオセンサー内部および表面のタンパク質層のみであるため、サンプル溶液中の夾雑物量など外部環境による影響を受けにくい。
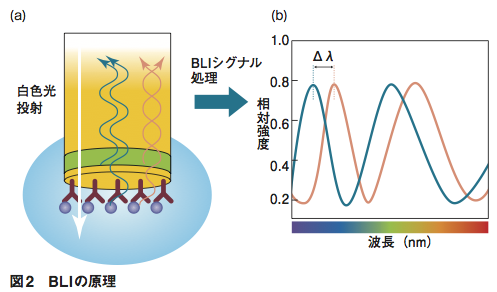
(a) センサーチップの内部から白色光を投射すると、屈折率が変化する界面で一部の光が反射する。それぞれの界面で反射した光同士が干渉を起こす。センサー表面に固定化した分子に他の分子が結合すると、反射の界面位置が変化する。それによって、反射光の干渉の仕方も変わる。(b)反射光のスペクトル上で、ピークのシフト(Δλ)が起こる。これを解析することで、センサー表面に形成された高分子の膜厚がわかる。
ELISAやWestern blottingに替わるアプリケーション
日本ポールでは、BLItz専用のバイオセンサーラインナップとして、ストレプトアビジン、Protein A/G/L、Ni-NTA、そしてヒトIgG Fc、マウスIgG Fc、FLAG、GSTに対する抗体などが固相化されたものを取り揃えている。これにより、これまでELISAやWestern blottingにより行ってきたターゲットタンパク質の存在確認を、BLItzで行うことも可能だ。アッセイ時間も圧倒的に短縮できる。さらに反応速度を指標として、in vitro 反応系の条件最適化に利用することもできるだろう。
簡便かつ豊富な情報量を持つ分析により、これまで複雑な実験系を経なければ得られなかったデータを、数分のうちに手にすることができるようになる。その違いがもたらす恩恵は、大きなものになるはずだ。
●日本ポール株式会社
[所在地] 〒163-1325 東京都新宿区西新宿 6-5-1
[TEL] 03-6386-0995
[E-mail] [email protected]
[URL] http://www.blitzmenow.com/