網羅的なタンパク質解析で明らかになってきたヒストンメチル化の新領域 from 「BIO GARAGE」vol.22
ヒストンメチル化の基質が作られてからメチル化が起こるまでのメカニズムについては、未だ不明な点が多い。2011年にMolecular Cellにおいて、メチル化の基質合成とヒストンメチル化のつながりについて新たな報告をした、東北大学医学系研究科五十嵐和彦教授にお話を伺った。

五十嵐 和彦(いがらし かずひこ)氏
東北大学大学院医学系研究科生物化学分野教授
医学博士(東北大学1991年)
1991年シカゴ大学博士 研究員
1993年 東北大学助手
1995年 筑波大学講師
1999年 広島大学教授
2005年より現職。
はじまりはヘムが関与する転写
五十嵐氏は、血球分化や酸素応答に関わる転写因子Bach1、Bリンパ球で特異的に働く転写因子Bach2、がん遺伝子産物MafファミリーのひとつであるMafKを中心に、転写制御のメカニズム解析を進めている。特にBach1、Bach2は、ヘム合成酵素に関する研究の一環として赤血球の分化について解析している時に、MafKのtwo-hybrid法で見つけてきた思い出深い転写因子だ。
「リコンビナントBach1の機能解析を進めるべく精製をしていた時に、常に茶色のフラクションとしてBach1が精製されてきました。それを見た教授の林典夫先生が、ヘムが結合している可能性を挙げてくださったことで、ヘムがBach1の機能発現に寄与していることが明らかになっていきました」と、当時を振り返る。現在では五十嵐氏らの研究成果から、Bach1にはp53依存的にp53標的遺伝子を抑制する経路と、MARE(Maf recognition element)という標的遺伝子上流にある制御配列に結合することで転写を抑制する経路があることがわかっている。
質量分析で見えてきた複合体によるエピジェネティックな制御
質量分析を使った解析から、上述の両方の経路においてエピジェネティックな制御ネットワークが関与していることを、五十嵐氏らは見いだしている。前者の場合は、一部のp53標的遺伝子(prep, p21 )上流にBach1、p53、HDAC1、N-CoRを含む複合体が形成され、ヒストンの脱アセチル化によって遺伝子発現が抑制されるメカニズムの一端を明らかにしている1)。
後者の経路では、転写抑制でBach1と二量体を形成しているMafKの質量分析が大きな発見につながった2)。冒頭で紹介した2011年のMolecular Cellでの発表だ。ヒストンのメチル化はS-アデノシルメチオニン(SAM)を基質として、メチル基転移酵素によって引き起こされる。MafKの解析でみえてきたのは、不明だった核内でSAMを供給するメカニズム。質量分析による網羅的な解析によって、思いもよらぬ形で五十嵐氏らはこの問題にメスを入れることになる。
MafKが導いたヒストンメチル化反応の新規モデル
S-アデノシルメチオニンは、ATPとメチオニンから合成される。その合成酵素であるMATIIが、MafK複合体に含まれていたのだ。MATIIの触媒サブユニットにエピトープタグをつけて精製し、解析した結果は、MATIIがメチル化反応を行う大きな複合体の一部として機能している可能性を示唆していた。そこにはSwi/Snf、NuRDといったクロマチンリモデリング因子、G9aやEhmt1などのヒストンメチル化酵素など、実に多様な因子が複合体に含まれていたのだ。
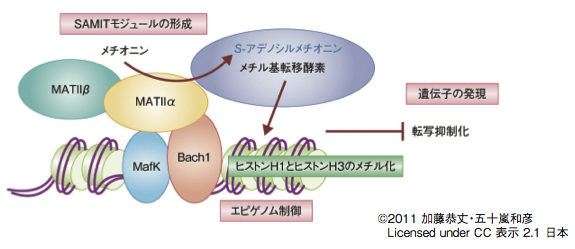
クロマチン免疫沈降、siRNAによる関連因子のノックダウン、ヒストンメチル化解析の中から、SAMITと名付けたMATIIα/βで構成されるモジュールによるメチル化制御のメカニズムが見えてきた(図1)。「MATIIと転写因子をつなぐプラットフォーム、MATIIのリクルートなど解析したいことがたくさんあります」と、この新しいモデルの詳細の解明に五十嵐氏は意欲を見せる。

MATIIのαサブユニットがメチオニンとATPからS-アデノシルメチオニン(SAM)を合成する。
合成されたSAMを基質としてG9aなどの複合体に含まれているメチル基転移酵素がヒストン
H1、ヒストンH3をメチル化して、Bach1の標的遺伝子であるHO-1の転写を抑制している。
新たな手法でエピジェネティクス研究を加速する
SAMITのケースは、エピジェネティクスに関連している因子が、巨大な複合体ネットワークを作って、転写を制御していることを物語っている。こうした複雑なネットワークをひも解くには、質量分析だけでは足りない。「精製されてきた複合体が、単一の複合体なのか、複数の複合体の総和なのかが、わかりません」と五十嵐氏は指摘する。
シグマ アルドリッチはDuolink、AQUAペプチドというエピジェネティクス研究を支援する機会を提供している。Duolinkは、2種類の抗体と、異なるDNAプローブで標識した二次抗体を利用し、一次抗体の結合部位が近接しているか否かを非常に好感度のin situ ハイブリダイゼーションによって検出するシステムだ(図2)。上述した複合体の問題にアプローチする上で、効果を発揮してくれるのではないかと五十嵐氏は関心を寄せる。また、片方の抗体をリン酸化、メチル化、アセチル化に特異的な抗体にすれば、翻訳後修飾の解析にも使えるだろう。
またAQUAペプチドは、炭素、窒素の安定同位体ラベルで標識したペプチドを使い、質量分析によって安価かつ標識不要で相対的定量を行うためのソリューションだ。修飾ヒストンも含めたトータルのヒストンの量的な動態変化の解析も試みる五十嵐氏は、定量的な質量分析ができる点はありがたいと話す。
新たに生まれてくるテクノロジーは、五十嵐氏の研究にも追い風となるはずだ。SAMITをはじめとした新たなエピジェネティクスの概念を作る研究成果を楽しみにしたい。
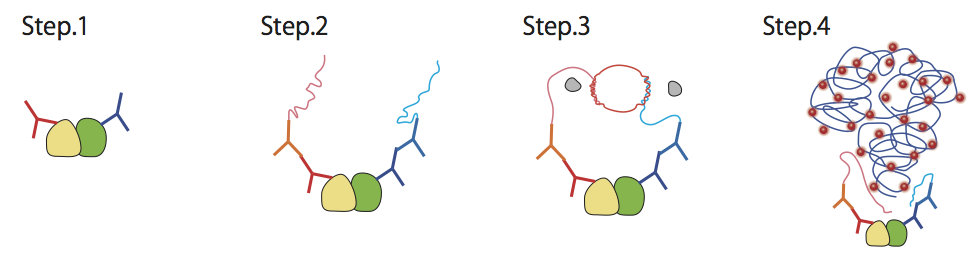
Duolinkでは、まず2種類の一次抗体によって標的部位を捕捉する(Step1)。そこにDNAプローブで標識された二次抗体を加え、一次抗体を捕捉する(Step2)。
ここに、in situの標的配列を含むプローブとリガーゼ溶液を加えると、ライゲーション反応が起こり、環状DNAができる(Step3)。環状DNAからin situ の標的配列がタンデムに並ぶ一本鎖DNAが伸長反応で作られ、in situ ハイブリダイゼーションを行い、シグナルを検出する。標的部位が近接していれば、高感度でシグナルが検出される。
- Dohi, Y., Ikura, T., Hoshikawa, Y., Katoh, Y., Ota, K., Nakanome, A., Muto, A.,Omura, S., Ohta, T., Ito, A., Yoshida, M., Noda, T., and Igarashi, K. Bach1inhibits oxidative stress-induced cellular senescence by impeding p53function on chromatin. Nature Struct. Mol. Biol. 15, 1246-1254. 2008.
- Katoh, Y., Ikura, T., Hoshikawa, Y., Tashiro, S., Ohta, M., Kera, Y., Noda, T. and Igarashi, K. Methionine adenosyltransferase II serves as a transcriptional corepressor of Mafoncoprotein. Mol. Cell 41, 554-566. 2011.
Duolink,AQUA ペプチドに関するお問い合わせはこちら
●シグマ アルドリッチ ジャパン
[ 所在地 ] 東京都品川区東品川2-2-24 天王洲セントラルタワー4F
【Duolink】
[ U R L ]Sigma.com/duolinkjapan
[ T E L ]03-5796-7330 [ E-mail ][email protected]
【AQUAペプチド】
[ U R L ]sigma.com/aquapep-jp
[ T E L ]0133-71-2471 [ E-mail ][email protected]
