光学の限界を超える超解像イメージング
今年のノーベル化学賞が、超解像顕微鏡を開発した
Eric Betzig氏、Stefan W. Hell氏、William E. Moerner氏の3名に授与されたことは記憶に新しい。
細胞内外の微細構造を捉えるべく、いま超解像イメージングは多様な技術が出揃ってきている。
蛍光観察の分解能を決める光学の壁
通常、光学顕微鏡の分解能(接近している2点を区別できる最小距離)は、以下の式で決定される(係数0.61は実際に観察する光によって異なるが、ここではレイリーの式を採用した)。
δ = 0.61λ/NA
NA = n sinθ
NA:開口数
n:媒質の屈折率
θ:開口角(軸上の1点から対物レンズに入る光のうち最も外側の角度)
通常の蛍光顕微鏡観察であれば、nは油浸レンズの場合で1.515、sinθの最大は0.95であり、NAの最大値は1.45程度となる。そのため、例えば波長550nmの緑色光では分解能は
δ = 0.61 × 550nm / 1.45 ≒ 231 nm
となり、これ以上に近接した2点を区別することはできない。しかし、実際の細胞の中では、タンパク質や核酸はもっと近接し合っている。光学の限界にしばられる限り、このような詳細な位置関係を解析することはできなかった。

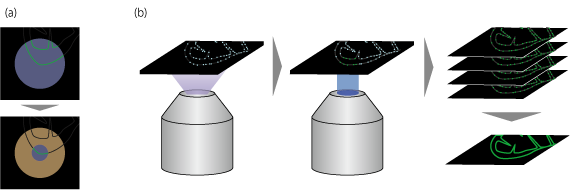
図1 STED顕微鏡、PALMのしくみ
(a) STED顕微鏡では、通常のレーザー共焦点顕微鏡と同様に蛍光分子を励起(上、紫の円が励起光)した後、ドーナツ状のSTED光(下、オレンジ)で周辺部を消光することで、狭い範囲だけが励起されるようにしている。
(b) PALMでは、まず弱い紫外光で蛍光分子をオン(励起光により励起される状態)にしてから、励起光を当てて観察する。どこにある蛍光分子がオンになるかは確率的に決まるため、近接した2点が同時に光る(分解能の限界により区別できない)という現象が起こる可能性は少ない。これを数十回繰り返して画像を重ね、1枚の像をつくる。
ノーベル賞を受賞した2つの技術
この光学上の限界をクリアしたのが、超解像顕微鏡である。Hell氏が開発したSTED(Stimulated Emission Depletion)は、「見たい部分以外を光らせない」というアプローチを取った。励起光のレーザーを照射した後、励起領域の中心部を除くドーナツ状の領域にSTED光を当てる。STED光は、励起した蛍光分子を強制的に基底状態に落とすためのもので、結果として中心部だけが本来の蛍光を発するようになるのだ。ただし、原理的に分解能が高くなるのはXY平面のみであり、Z軸方向への分解能は通常のレーザー共焦点顕微鏡と変わらない(約500〜700nm程度)。STED顕微鏡はすでにライカマイクロシステムズ社から販売されており、同社サイトでその取得像を確認することができる。
一方、Betzig氏とMoerner氏が開発したPALM(Photo activated Localization Microscopy)のアプローチは「分解能以上に近接した蛍光分子を同時には見ない」というものだ。この技術では、紫外光照射によって蛍光のオン/オフ切り替えが可能な色素を用いる。まず観察領域全体に弱い紫外光を当て、蛍光分子を確率的に励起させる。つまり、この時点で、励起光を当てると光る分子と、光らない分子が出てくるわけだ。そこに励起光を照射し、撮像する。また全体の蛍光分子をオフにしてから、同様のことを繰り返す。こうして大量の画像を取得した後で重ね合わせることで、高解像度の1枚の画像にしている。PALMの強みは、STEDに勝る分解能(XY平面で30nm程度、Z軸で150〜最小20nm程度)である。一方、利用できる色素が限られていること、また蛍光のオン/オフ切り替えに使用する光として近接場光を利用しているため、底面から離れた部分は観察できないこと、数十枚の画像の重ねあわせが必要なために撮像に時間がかかるという弱みもある。この技術が用いられた顕微鏡がカールツァイス社から、また同様の技術であるSTORM(Stochastic optical reconstruction microscopy)が用いられた顕微鏡がニコンから販売されている。
| 表1 | STED※ | PALM | SIM | FV-OSR |
| XY平面解像度 | 20-100nm | 20-50nm | < 115nm | 120nm |
| Z軸解像度 | 560nm | 20-100nm | 250nm | 未公開 |
| 使用できる蛍光分子 | 多くの蛍光分子を
使用可能 |
蛍光/消光モード切り替えが可能である必要がある | 多くの蛍光分子を使用可能(退色が遅い物が望ましい) | 通常の蛍光分子が使える |
| 時間分解能 | 数十msec | sec-min | 数百msec | 未公開 |
※STEDはパルス光でなく可視領域の連続波を使用するContinious Wave(CW)-STEDの性能を示した
選択肢が多様化する超解像観察
ノーベル賞が授与されたのは以上2つの超解像技術であるが、他にも従来の光学顕微鏡の限界を超えるものが市販されている。そのひとつが、オリンパス独自の超解像技術FV-OSRだ。レーザー共焦点顕微鏡の場合、先ほどの分解能を求める式の係数(0.61)がピンホール径によって変化し、ピンホール径が無限小の場合に0.37となる。共焦点顕微鏡像には分解能200nmを超える画像成分が含まれているわけだが、そのままではコントラストが弱く、観察することができない。そこで、FV-OSRでは、ピンホールを通常より絞り込むことでこの超解像成分のコントラストを上げ、強調処理することで、XY平面で約120nmの分解能を実現している。
また、ニコンが採用するSIM(Structured Illumina tion Microscopy)は、縞模様の光を観察対象に照射する。サンプル内に通常の光学分解能以下のサイズの蛍光パターン(細胞骨格やオルガネラ構造など)があった場合、照射した縞模様と干渉を起こし、モアレ効果と呼ばれる荒いパターンを観察できる。このモアレパターンには元の蛍光パターンの情報を含むため、照射する縞模様の角度を変えて複数枚撮像し、重ねあわせた上で数学的な処理をすることで、超解像観察ができるのだ。この技術はPALMと同じく重ねあわせが必要であるが、その枚数は少なくで済むため、1.67フレーム/秒でのライブイメージングも可能となっている。
顕微鏡メーカー各社からアプリケーションが提供されてきたことは、共局在など解像度が求められる解析を行うユーザーにとっては朗報と言えるだろう。
