【at a Glance】狭まりつつある「希少・難治性疾患包囲網」
ここ数年、大手の製薬企業が次々と希少・難治性疾患の治療薬開発に名乗りを上げている。2010年2月にGlaxoSmithKlineが希少疾患治療薬の研究・開発に特化したユニットを設立し、2011年2月にはSanofi-Aventisがバイオ医薬企業のGenzymeを買収、希少疾患の治療薬市場に進出した。アメリカを例に取ると、希少疾患を対象とした開発パイプラインの数は1991年には176だったのが2007年には303、そして2011年には460にまで増加している※。
功を奏し始めた基礎研究
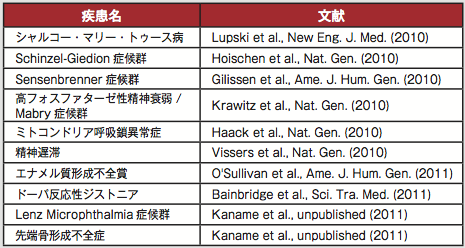
希少・難治性疾患治療薬市場の盛り上がりの背景には、ひとつは各社が保有する治療薬の特許が切れ始めたことで、新たな市場を模索する動きを始めたという事情がある。しかし同時に、基礎研究の進展により、希少・難治性疾患に関するサイエンスのバックボーンが強化されてきているという事情も大きい。病態発症のパスウェイが明らかになることで、すでに上市していたり、他の疾患に対する治療薬として開発中であった化合物を、新たな疾患に適用できる可能性があるのだ。また次世代シークエンサーの発展によるゲノム解析のコストダウン効果は目覚しく、様々な疾患の原因遺伝子の特定に役だっている(表1)。
次のターゲットはメカニズムと治療
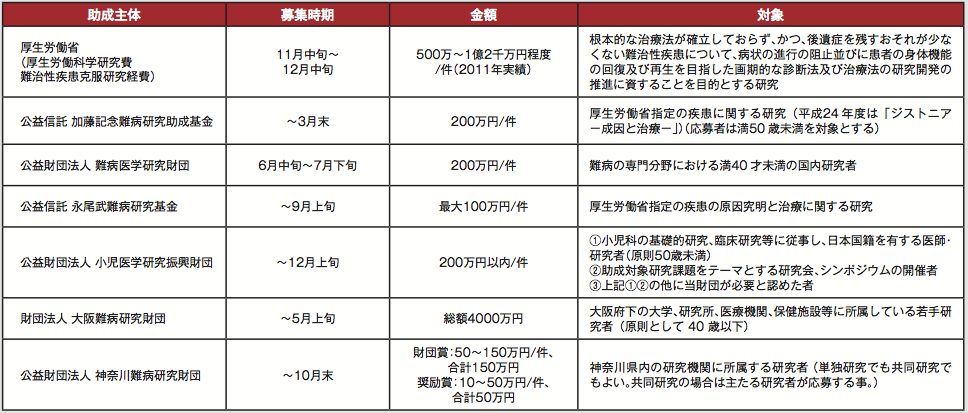
次々と解明される、疾患の原因遺伝子。しかし原因がわかったからといって、すぐに分子機構まで解明できるわけではなく、治療方法となるとハードルはさらに高い。その中で最近注目を集めているのは、やはりiPS細胞だ。次ページ以降で、iPS細胞を用いて疾患の病態解明を目指す研究、治療方法の開発を行う研究を紹介する。またそれほど多様ではないが、難病にターゲットを絞った研究助成金も年間を通じて色々な時期に募集がある(表2)。
次々世代の治療薬開発のためには、原因から病態発症までのパスウェイ解析と、それを阻害する方法に関する基礎研究のさらなる蓄積が欠かせないだろう。今後間違いなく世界のトレンドとなる希少・難治性疾患研究の発展に期待したい。
iPSによって可能になる、生細胞を用いたアルツハイマー病研究
すでに患者数は世界で1500万人を超え、希少疾患とは言いがたいアルツハイマー病。しかし病態発症のメカニズムについて詳細はまだ不明であり、治療方法も確立されていない。その理由のひとつに、中枢神経の変性疾患であるがゆえに生検を取れず、「生(なま)の」状態を捉えることが難しいことが挙げられる。患者の繊維芽細胞からiPS化を経て神経へと分化させる技術が、その状況を変えようとしている。
アルツハイマーを再現した培養細胞
カリフォルニア大学サンディエゴ校のIsraelらは、アルツハイマー病を発症した患者からiPS細胞を樹立し、ニューロンに分化させてその性状を調べた1)。特に病態との関連が示唆されているβアミロイド(Aβ)、リン酸化タウタンパク質(p-tau)、そしてそのリン酸化酵素であるGSK-3βにフォーカスして解析が行われた。アルツハイマー病は、古くから大脳皮質へのAβの蓄積が原因として疑われている。一方で発症前にp-tauが細胞質中で線維化して沈着することも知られているが、Aβ蓄積とp-tau沈着、そして発症との因果関係はまだ明らかにされていない。この研究では、まずiPS細胞由来ニューロン中でのAβとp-tau、GSK-3βの量が確かめられた。その結果、家族性アルツハイマー病患者および突発性の患者のうち1名では、臨床例と同様に3つのタンパク質量がいずれも増加し、またそれぞれの増加量が強い相関を持っていることが明らかにされた。
シャーレの中でパスウェイを紐解く
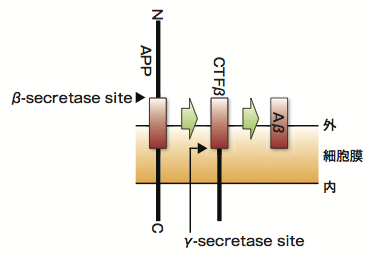
Aβは、アミロイド前駆体タンパク質(APP)がβ-secretaseおよびγ-secretaseによって切断されることによって産生される(図1)。そこでそれらの酵素を阻害する薬剤を投与し、Aβ量とp-tau、GSK-3β量に与える影響が調べられた。すると、β-secretaseを阻害したときのみ、p-tauとGSK-3βの量が減少することが明らかになった。このことは、Aβでなく、他のAPP切断産物がGSK-3βの活性に影響を与え、tauのリン酸化を促していることを示唆している。このような薬剤投与によるパスウェイ解析は、生きた細胞を用いるからこそ可能なものだ。論文では、さらに患者由来のニューロンではβ-secretaseが局在するエンドソームが肥大することを示し、前シナプス局在タンパク質の量に及ぼす影響を調べようとしている(論文中に示された条件では、患者と健常者との間で差は見られなかった)。
生細胞が新たな知見を生む
従来は、患者の組織を用いて病態の解析を行うためには、症状を示す部位を生検として取らなければならなかった。それが採取しやすい繊維芽細胞からiPS細胞を経て発症する細胞に分化させることで、薬剤投与試験を行ったり、細胞構造を観察したりといった解析が可能になったのだ。著者らは論文の最後で、より多くの患者と健常者から樹立したiPS細胞を用いた研究により、突発性アルツハイマーに見られる多様な臨床所見の原因や患者ごとに異なる薬剤の効能、早期診断方法など、様々な知見を得られるだろうと述べている。それはアルツハイマーに限らず、他の疾患にも当てはまるはずだ。
1) Manson A. Israel et al. (2012). Probing sporadic and familial Alzheimer's disease using induced pluripotent stem cells. Nature. 482, 216-220
体外で遺伝子を治し、体内へ戻す
iPS細胞によって現実味が増した治療法のひとつに、体細胞遺伝子治療がある。従来はウイルスベクターやリポソームを用いて、あるいはプラスミドDNAをそのまま注射することで体細胞に遺伝子導入を行う手法が研究されてきたが、それが適用できる組織には限りがあるし、遺伝子が挿入される部位によってはがん化など思わぬ副作用が生じる可能性もある。患者から樹立したiPS細胞に遺伝子治療を施して体内に戻すことが、新たな医療となるかもしれない。
他者からの臓器移植に代わる治療法
2011年10月、先天性の肝臓疾患である「α1アンチトリプシン欠損症」の遺伝子治療に関する論文が『Nature』に掲載された2)。それを成し遂げたのは、日本人の遊佐宏介博士を含むイギリスのウェルカムトラストサンガー研究所、茨城県にあるベンチャー企業ディナベックなどの研究グループだ。この疾患の患者はα1アンチトリプシンを欠損するために、肝細胞の小胞体内でタンパク質が秩序だったポリマーを形成し、肝硬変を引き起こす。これまでは肝臓移植以外に治療方法がない疾患だった。
研究グループは、まず患者から採取した繊維芽細胞からiPS細胞を樹立した。そして、変異型のα1アンチトリプシン遺伝子(A1AT)を正常なものに入れ替えてから肝細胞に分化させ、同じ疾患を持つマウスに移植した。その結果、マウスの肝臓全体にヒトiPS細胞由来の組織が行き渡り、α1アンチトリプシンを作っていることが確かめられた。
新しい治療こそ、細心の注意を払う
この成果は、iPS細胞に遺伝子治療を施し、移植医療に活かすことの有効性を証明したという以外に、技術的にも大きな成果を成し遂げた。遺伝子導入にPiggyBacと呼ばれるトランスポゾンを用いることで、遺伝子改変時の余計な痕跡を残さなかったのだ。培養細胞に遺伝子治療を行う際、薬剤耐性などの選択マーカーを除去するためによくCre/loxPやFlp/FRTが用いられる。これらはloxPやFRTと呼ばれる配列で除去したい部分を挟み、CreやFlpといったリコンビナーゼによって組換えを起こすことによって挟んだ領域を除去するテクニックだが、片方のloxPやFRTが残ってしまうという問題がある。細胞を体内に戻したあと、長期的にどのような影響を与えるかが未知数なのだ。
遊佐らが研究で用いたPiggyBacは両端に「TTAA」という4塩基を持ち、遺伝子中のTTAAをターゲットにして挿入されて、トランスポゼースによって痕跡を残さずに除去されるシステムだ(図2)。彼らは治療用遺伝子カセット中の薬剤耐性遺伝子をPiggyBacによって除去することで、余計な改変が起こらないようにしたのだ。
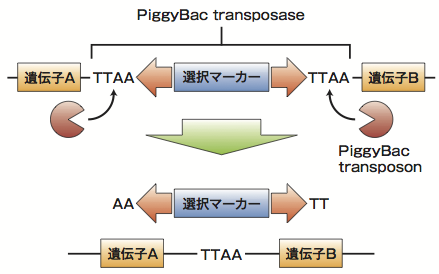
図2 PiggyBacの仕組み
実際にはA1AT中にはTTAAという配列が無かったため、TTAAに置き 変わってもアミノ酸配列が変化しない部分(元の配列はCTGA)を利用す るという巧妙な工夫を行った。
iPS細胞を治療に応用する研究は、まだ始まったばかりだ。もし移植を行ったあと、長期間が経過した後で何か問題が起きたら……その可能性は、誰にも検証できていない。だからこそ、できる限り人為的な改変を少なくすることで、予期せぬトラブルの可能性を減らすことが重要なのだ。
2) Yusa, K. et al. (2011). Targeted gene correction of α1-antitrypsin deficiency in induced pluripotent stem cells. Nature. 478. 391-394