【読物】タンパク質の「機能」を分子シミュレーションで解き明かせ!(vol.20)
タンパク質の「機能」を分子シミュレーションで解き明かせ!
2013年のノーベル化学賞は、タンパク質などの生体内の高分子の化学反応をシミュレーション計算する新しい手法に
対して贈られました。今回は、タンパク質の「機能」を早く正確に予測したい!という科学者の夢を実現するために、こ
れまでどのような歴史があったのか、そしてこれからどのような生物学の時代が到来するのかご紹介します。
キーワード:タンパク質の「形」と「機能」
生命現象を支えるタンパク質の「形」と「機能」
タンパク質は生物の生体機能の主要な役割を担っています。その種類は一種類の生物の中でも数千~十数万種類といわれ、それぞれが異なる「形」と「機能」を持ち複雑に相互作用しながら生命現象を支えています。非常に多様性に富んでいますが、20種類のアミノ酸が直鎖状につながり、形作られている点は同じです。 この多様性は、アミノ酸の配列によって決定されています。例えば200個のアミノ酸からなる一般的には小さめのタンパク質ですら、20200 = 1.6 ×10260と、天文学的な組み合わせをもちます。 1961年にアミノ酸配列がタンパク質の「形」を決めていることが発見されてから、世界中の生物学者や計算科学者はアミノ酸配列からタンパク質の「形」と「機能」を予測することを夢見てきました。この夢を実現するためには、大きく分けて二段階のステップが必要です。まずは、「アミノ酸配列から形を予測すること」。次に、「形から機能を予測すること」です。
ミッション1:アミノ酸配列から「形」を予測せよ!
DNA配列によって決められるアミノ酸の配列は、現在のDNAシーケンス技術を用いることで簡単に決定することができます。しかし、「形」を決定するためには、X線結晶構造解析や核磁気共鳴分光法といった大がかりな手法を用いなければならず、アミノ酸配列決定と比べ何百倍、何千倍以上もの労力と時間を必要とします。 そこで、より手軽に「形」を決定するために、コンピューターを使って予測する試みが進められてきました。これまでの研究からアミノ酸配列が20~30%程度同じであれば、タンパク質の「全体のおおまかな形」は同じであることがわかっています。もしアミノ酸配列が似ているタンパク質の「形」がすでにX線結晶構造解析などでわかっている場合、そのデータを元に未知のタンパク質の「全体のおおまかな形」を推測することができます。 タンパク質の「基本的な形」は一説では10,000程度とされています。そこで、2000年代前半、全世界の研究機関で協力して、まず「基本的な形」を全て決定してしまおう、という取り組みが行われました。現在、データベースに登録されているタンパク質の「形」は、全世界で90,000個以上にも達しています。この情報を利用することで、未知のタンパク質のアミノ酸配列からでも、70%以上の割合で「全体のおおまかな形」を予測することが可能となりました。
ミッション2:「形」から「機能」を予測せよ!
次は、「形」を元に、「機能」を推定することを目指さねばなりません。「機能」の推定には、分子を構成する原子一つ一つの動きを量子力学的に、正確に計算することが必要ですが数千~数万もの原子をシミュレーションによって予測するためには莫大な計算量が必要なため、ほとんど不可能といえます。一方で、計算を単純化すれば、タンパク質全体のおおまかなふるまいは予測できるかもしれませんが、肝心の「機能に重要な部分」の化学反応を予測することはできません。 このジレンマを解消する新しい計算方法を編み出したのが、今年度のノーベル化学賞を受賞した米ハーバード大学のカープラスさんら三名です。彼らは「機能に重要な部分」は量子力学を用いて正確に計算し、それ以外の部分に関しては古典力学で近似しておおまかに計算する、という「良いとこどり」の手法を使うことで、1977年、58個のアミノ酸からなる「ウシ脾臓トリプシンインヒビター」の原子の動きを予測することに成功しました。 これが史上初の生体高分子のシミュレーションとなり、この手法を基本としてコンピューターシミュレーションの分子予測技術は加速度的な発展を遂げました。現在では、タンパク質の化学反応予測の信頼性が上がり、「機能」を推定するための強力なツールとなっています。
同じ形でも違う機能?夢の実現を目指して
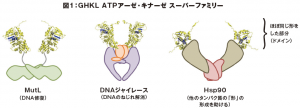
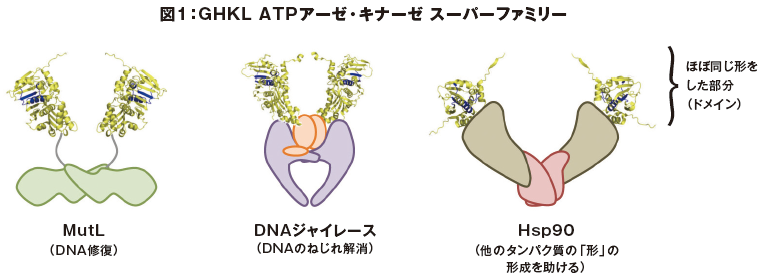
アミノ酸配列からタンパク質の「おおまかな全体の形」を予測することに使えるデータベースと、形から「機能」を予測する計算技術がそろった今、「アミノ酸配列からタンパク質の機能を予測する」という科学者の夢は現実のものとなったのでしょうか? 残念ながら、その領域にはまだ達していません。「おおまかな全体の形」からでは機能を正確に予測することは難しいのです。 例えば、私たちが持つタンパク質の一つ、517個のアミノ酸からなるアセトアルデヒド脱水素酵素の、487番目のアミノ酸の種類がグルタミン酸かリシンかの違いによって、アルコールに強いか、弱いかが大きく異なります。この二つの分子全体の形はほとんど変わりません。 このように、アミノ酸配列と形が似ているのに、機能が全く異なるタンパク質というのは珍しくありません。例えば、DNA修復の際、損傷のあるDNAを切断する役割をもつ MutLと、それとは異なる機能をもついくつかのタンパク質は、ほぼ同じ形をしたタンパク質の部分(ドメイン)を共通に持っています(図1)。これらは、原初の生命においては一種類のタンパク質であったものが、進化の過程の中で多様化していったものだと考えられています。 「アミノ酸配列からタンパク質の機能を予測する」ためには、今後の課題として、アミノ酸配列からより精密に形が予測できるようになる必要があります。今後、更に高度な分子シミュレーションや、「京」に次ぐようなスーパーコンピューターが開発されることによって、夢が実現する日が来るかもしれません。その方法が発見できれば、実際のタンパク質を用いた実験をせずに、DNAの情報だけで無数に存在するタンパク質の機能を推定することができるはずです。 究極的には、細胞全体を丸ごとコンピューター内にシミュレーションし、疑似的に生命を創造する、といった壮大な研究や、コンピューター内だけで創薬のための実験をする、といったことも可能になるかもしれません。
関連情報
Dutta R, Inouye M. (2000) TrendsBiochem Sci., 25(1):24-8., GHKL, anemergent ATPase/kinasesuperfamily.